Insuffisance cardiaque : Causes, types, diagnostic, traitements et prise en charge
Insuffisance cardiaque
L’insuffisance cardiaque est un syndrome clinique complexe résultant d’une anomalie structurelle ou fonctionnelle du cœur, compromettant la capacité du ventricule à se remplir de sang ou à l’éjecter. C’est un problème majeur de santé publique dans le monde entier. Alors que l’incidence des maladies coronariennes et des infarctus aigus du myocarde a été réduite d’environ 50 % au cours des dernières décennies, l’incidence de l’insuffisance cardiaque est restée stable, voire en augmentation du fait du vieillissement de la population. De nouvelles données suggèrent que l’incidence de l’insuffisance cardiaque chez les jeunes adultes a augmenté ces dernières années (Nabel et al., Savarese et al.). Il s’agit d’une tendance paradoxale et inquiétante, en particulier à la lumière des améliorations apportées à la prise en charge de l’hypertension (les maladies coronariennes et l’hypertension sont traditionnellement considérées comme les principaux facteurs de l’insuffisance cardiaque). On pense que le vieillissement de la population et la prévalence accrue de l’obésité, du diabète et de la dysglycémie favorisent la pandémie d’insuffisance cardiaque. En effet, de plus en plus de données suggèrent que l’insuffisance cardiaque est désormais la complication la plus fréquente du diabète (Shah et al., McMurray et al.).
La prise en charge de l’insuffisance cardiaque a progressé rapidement. Les bêta-bloquants, les inhibiteurs de l’ECA (enzyme de conversion de l’angiotensine) et les antagonistes des récepteurs de l’angiotensine (ARA) ont été introduits dans les années 1980-90 et ont permis d’améliorer considérablement la survie. Lorsque les pionniers Waagstein, Hjalmarsson et Swedberg ont proposé d’utiliser les bêta-bloquants – qui ont des effets inotropes et chronotropes négatifs – pour traiter l’insuffisance cardiaque, ils ont été accueillis avec scepticisme. Leurs études de référence ont prouvé que les bêta-bloquants prolongent la vie, soulagent les symptômes et réduisent le risque d’hospitalisation. Plus récemment, le paradigme du traitement a changé avec l’avènement des ARNI (inhibiteurs de l’angiotensine et de la néprilysine) et, surtout, des inhibiteurs du SGLT2 (gliflozines), qui constituent désormais les piliers fondamentaux de la thérapie.
L’insuffisance cardiaque est une maladie grave dont le pronostic à long terme reste sombre malgré les progrès thérapeutiques. Le taux de survie à 5 ans après une hospitalisation pour insuffisance cardiaque est d’environ 50 à 60 %, ce qui est comparable, voire pire, à de nombreux cancers courants (Stewart et al.). En outre, l’insuffisance cardiaque est une maladie invalidante qui a un impact très négatif sur la qualité de vie. Environ la moitié des patients souffrant d’insuffisance cardiaque meurent subitement des suites d’arythmies ventriculaires malignes (tachycardie ventriculaire, fibrillation ventriculaire) ou d’une défaillance de la pompe cardiaque (choc cardiogénique). Un diagnostic précoce et une prise en charge agressive selon les recommandations actuelles peuvent prolonger la survie, améliorer la qualité de vie, réduire les hospitalisations et le risque de mort subite.
Selon l’American Heart Association (AHA) et la Société européenne de cardiologie (ESC), il existe trois types d’insuffisance cardiaque : HFpEF, HFmrEF et HFrEF. Cette classification repose principalement sur la mesure de la fraction d’éjection du ventricule gauche (FEVG). La majorité des essais cliniques historiques ont été réalisés sur l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF). Cependant, l’insuffisance cardiaque à fraction d’éjection préservée (HFpEF) représente désormais environ la moitié des cas, en particulier chez les personnes âgées et les femmes. Contrairement aux idées reçues passées, nous disposons désormais de traitements efficaces (notamment les inhibiteurs du SGLT2) pour l’HFpEF.
Tableau 1. Types d’insuffisance cardiaque.
| Type d’insuffisance cardiaque | Description de l’insuffisance cardiaque | Fraction d’éjection (%) |
|---|---|---|
| HFrEF | Insuffisance cardiaque avec fraction d’éjection réduite | ≤ 40% |
| HFmrEF | Insuffisance cardiaque avec fraction d’éjection modérément réduite (mildly reduced) | 41-49% |
| HFpEF | Insuffisance cardiaque avec fraction d’éjection préservée | ≥ 50% |
«
Dans l’insuffisance cardiaque avec fraction d’éjection réduite (HFrEF), la fonction systolique du ventricule gauche (fractiond’éjection) est altérée. Dans la HFpEF, il existe des signes cliniques d’insuffisance cardiaque malgré une fraction d’éjection normale (FE ≥ 50 %). Dans ce cas, le problème principal est souvent une dysfonction diastolique (défaut de relaxation ou augmentation de la rigidité ventriculaire). Dans l’HFmrEF, il existe des signes d’insuffisance cardiaque avec une fraction d’éjection dans la « zone grise » comprise entre 41 et 49 %. Ces patients partagent souvent des caractéristiques cliniques avec le groupe HFrEF et répondent généralement aux mêmes traitements.
Le diagnostic d’HFpEF nécessite, en plus de la clinique et de la FEVG préservée, la preuve objective d’anomalies structurelles ou fonctionnelles (élévation des pressions de remplissage, HVG, dilatation atriale gauche) et/ou une élévation des peptides natriurétiques.
La majorité des patients souffrant d’insuffisance cardiaque présentent une comorbidité importante. La cardiopathie ischémique, l’infarctus du myocarde, l’hypertension, les arythmies (notamment la fibrillation atriale), les maladies pulmonaires (BPCO), les maladies rénales chroniques, le diabète (type 1 et 2) et la carence en fer sont des affections coexistantes courantes. Cela complique le traitement en raison du risque d’interactions médicamenteuses et nécessite une approche multidisciplinaire.
Épidémiologie de l’insuffisance cardiaque
- L’insuffisance cardiaque touche environ 1 à 2 % de la population adulte dans les pays développés.
- La prévalence augmente fortement avec l’âge, atteignant plus de 10 % chez les personnes âgées de plus de 70 ans.
- 6,5 millions d’adultes aux États-Unis et plus de 15 millions en Europe souffrent d’insuffisance cardiaque.
- L’insuffisance cardiaque est la première cause d’hospitalisation chez les sujets de plus de 65 ans.
- Le risque de développer une insuffisance cardiaque au cours de sa vie est de 20 % pour une personne de 40 ans.
- Bien que la survie s’améliore, le taux de réhospitalisation reste très élevé (environ 25 % à 30 jours).
- Le diabète est un facteur de risque majeur : les patients diabétiques ont un risque 2 à 5 fois plus élevé de développer une insuffisance cardiaque.
Pronostic
Tableau 2. Survie à long terme après une hospitalisation pour insuffisance cardiaque.
| Temps écoulé depuis l’hospitalisation | Survie estimée (%) |
|---|---|
| 1 an | 70 – 75 % |
| 5 ans | 50 – 60 % |
«
La mortalité dans l’insuffisance cardiaque reste élevée, supérieure à celle de nombreux cancers (sein, prostate, colon). Les causes de décès se répartissent principalement entre la progression de l’insuffisance cardiaque (défaillance de pompe) et la mort subite cardiaque (arythmies ventriculaires). C’est pourquoi la stratification du risque rythmique est essentielle.
Causes et Physiopathologie de l’insuffisance cardiaque
Physiopathologie et Remodelage
L’insuffisance cardiaque commence souvent par un événement initial (index event) qui endommage le muscle cardiaque ou perturbe sa fonction. En réponse à la baisse du débit cardiaque, l’organisme active des mécanismes compensateurs neuro-hormonaux, principalement :
- Le système nerveux sympathique (SNS) : Augmente la fréquence cardiaque et la contractilité, et provoque une vasoconstriction périphérique.
- Le système rénine-angiotensine-aldostérone (SRAA) : Favorise la rétention hydrosodée (augmentation de la précharge) et la vasoconstriction (augmentation de la postcharge), et induit une fibrose myocardique.
Bien que ces mécanismes soient bénéfiques à court terme pour maintenir la pression artérielle, leur activation chronique devient délétère (« cercle vicieux »), entraînant une toxicité directe pour les cardiomyocytes, une fibrose et une apoptose. C’est ce qui conduit au remodelage cardiaque : dilatation du ventricule gauche, modification de sa forme (de ellipsoïde à sphérique), hypertrophie pathologique et altération progressive de la fonction contractile.
L’objectif fondamental du traitement pharmacologique moderne est de bloquer ces systèmes neuro-hormonaux (via les bêta-bloquants, IEC/ARA/ARNI, ARM) et d’améliorer l’énergétique myocardique (via les inhibiteurs du SGLT2) pour inverser le remodelage cardiaque (Reverse Remodeling).
Maladie coronarienne et cardiopathie ischémique
L’infarctus du myocarde (STEMI, NSTEMI) est la cause la plus fréquente d’insuffisance cardiaque (HFrEF) dans les pays industrialisés. La perte de tissu contractile (nécrose) et le remodelage post-infarctus sont les principaux moteurs de la dysfonction ventriculaire. L’ischémie chronique (myocarde hibernant) peut également induire une dysfonction réversible après revascularisation.
L’hypertension artérielle
L’hypertension est un facteur de risque majeur, particulièrement pour l’insuffisance cardiaque à fraction d’éjection préservée (HFpEF). L’hypertension chronique augmente la postcharge, forçant le ventricule gauche à s’hypertrophier (HVG) pour maintenir la tension pariétale. Cette hypertrophie entraîne une rigidité myocardique (dysfonction diastolique) et peut évoluer vers une dilatation et une dysfonction systolique si elle n’est pas traitée.
Le diabète et la cardiomyopathie diabétique
Le diabète est une cause fréquente et indépendante d’insuffisance cardiaque. La cardiomyopathie diabétique se caractérise par des modifications structurelles et fonctionnelles du myocarde en l’absence de maladie coronarienne ou valvulaire significative. Elle est liée à l’hyperglycémie, la résistance à l’insuline, la lipotoxicité et l’inflammation chronique, conduisant à la fibrose interstitielle.
Arythmies et cardiomyopathie rythmique
La bradycardie sévère ou les blocs de conduction peuvent réduire le débit cardiaque. Cependant, les tachyarythmies sont plus fréquemment en cause. Une fréquence cardiaque élevée et prolongée peut induire une cardiomyopathie rythmique (tachycardiomyopathie), potentiellement réversible si le rythme est contrôlé. La fibrillation auriculaire (FA) est l’arythmie la plus courante ; elle peut être à la fois la cause et la conséquence de l’insuffisance cardiaque, aggravant le pronostic.
Cardiopathies valvulaires et structurelles
Les valvulopathies non traitées imposent une surcharge hémodynamique (pression ou volume) au ventricule :
- Sténose aortique : Surcharge de pression (HVG concentrique).
- Régurgitation aortique et Mitrale : Surcharge de volume (Dilatation ventriculaire).
Toxiques et Chimiothérapie
- Alcool : La cardiomyopathie éthylique est une forme de cardiomyopathie dilatée fréquente, partiellement réversible à l’arrêt de l’intoxication.
- Cocaïne et amphétamines : Peuvent causer une toxicité directe, un vasospasme coronaire et une hypertension maligne.
- Chimiothérapies : Les anthracyclines (Doxorubicine) causent une toxicité dose-dépendante irréversible. Le Trastuzumab (Herceptin) cause une dysfonction souvent réversible. Les inhibiteurs de tyrosine kinase et l’immunothérapie (myocardite) sont également impliqués.
Causes génétiques et maladies de surcharge
Les cardiomyopathies familiales doivent être suspectées chez les sujets jeunes ou avec antécédents familiaux :
- Cardiomyopathie dilatée (DCM) : Mutations de la titine (TTN), lamine A/C (LMNA).
- Cardiomyopathie hypertrophique (CMH) : Mutations des protéines sarcomériques.
- Cardiomyopathie ventriculaire droite arythmogène (ARVC).
- Amylose cardiaque : Une cause de plus en plus reconnue d’HFpEF, due au dépôt de protéines amyloïdes (chaînes légères AL ou transthyrétine TTR) dans le myocarde, entraînant un épaississement des parois et une dysfonction diastolique sévère.
Symptômes et Signes Cliniques
Les symptômes cardinaux sont la fatigue et la dyspnée. La rétention hydrosodée entraîne congestion et œdèmes.
Symptômes typiques (Haute spécificité)
- Dyspnée d’effort (essoufflement).
- Orthopnée (nécessité de surélever la tête pour dormir).
- Dyspnée paroxystique nocturne (réveil brutal par manque d’air).
- Tolérance réduite à l’effort et fatigabilité.
- Œdèmes des membres inférieurs (prenant le godet), bilatéraux.
Symptômes moins typiques
- Toux nocturne, respiration sifflante (« asthme cardiaque »).
- Sensation de ballonnement, nausées (congestion hépatique et intestinale).
- Confusion (bas débit cérébral), dépression.
- Palpitations, vertiges, syncope.
- Bendopnée (essoufflement en se penchant en avant).
Insuffisance cardiaque aiguë décompensée
«
L’insuffisance cardiaque aiguë est une urgence vitale caractérisée par l’apparition ou l’aggravation rapide des symptômes nécessitant une hospitalisation immédiate. Elle se présente souvent sous forme d’œdème aigu du poumon (OAP) ou de choc cardiogénique. La figure 1 illustre la fréquence des symptômes lors de la décompensation.

Classification fonctionnelle NYHA
La classification NYHA reste la référence pour évaluer la sévérité fonctionnelle et guider le traitement.
Tableau 3. Classification fonctionnelle de la New York Heart Association (NYHA)
| Classe NYHA | Description clinique |
|---|---|
| I | Aucune limitation de l’activité physique. L’activité physique ordinaire ne provoque ni fatigue excessive, ni palpitations, ni dyspnée. |
| II | Limitation légère de l’activité physique. Confortable au repos, mais l’activité physique ordinaire entraîne fatigue, palpitations ou dyspnée. |
| III | Limitation marquée de l’activité physique. Confortable au repos, mais une activité inférieure à l’ordinaire provoque des symptômes. |
| IV | Incapacité à effectuer toute activité physique sans inconfort. Symptômes présents au repos. L’activité physique aggrave l’inconfort. |
Signes cliniques à l’examen physique
«
- Turgescence jugulaire et reflux hépato-jugulaire : Signes spécifiques de congestion veineuse systémique et d’élévation des pressions droites.
- Bruit de galop (B3) : Troisième bruit cardiaque protodiastolique, très spécifique de la dysfonction ventriculaire gauche et de l’élévation des pressions de remplissage.
- Choc de pointe (Apex) : Déplacé vers la gauche et étalé en cas de dilatation du VG.
- Auscultation pulmonaire : Râles crépitants aux bases pulmonaires (signe de congestion alvéolaire/œdème pulmonaire). Epanchement pleural (matité à la percussion).
- Tachycardie : Mécanisme compensateur fréquent.
- Arythmies : Irrégularité du pouls (FA, extrasystoles).
- Signes de congestion droite : Hépatomégalie (foie cardiaque), ascite, œdèmes périphériques (chevilles, jambes, sacrum chez le patient alité).
- Signes de bas débit : Extrémités froides, temps de recoloration cutanée allongé, oligurie, pression pulsée pincée (hypotension).
Démarche diagnostique
Le diagnostic repose sur la triade : Probabilité clinique (antécédents/examen) + Peptides natriurétiques + Échocardiographie.
Figure 2. Algorithme diagnostique de l’insuffisance cardiaque.
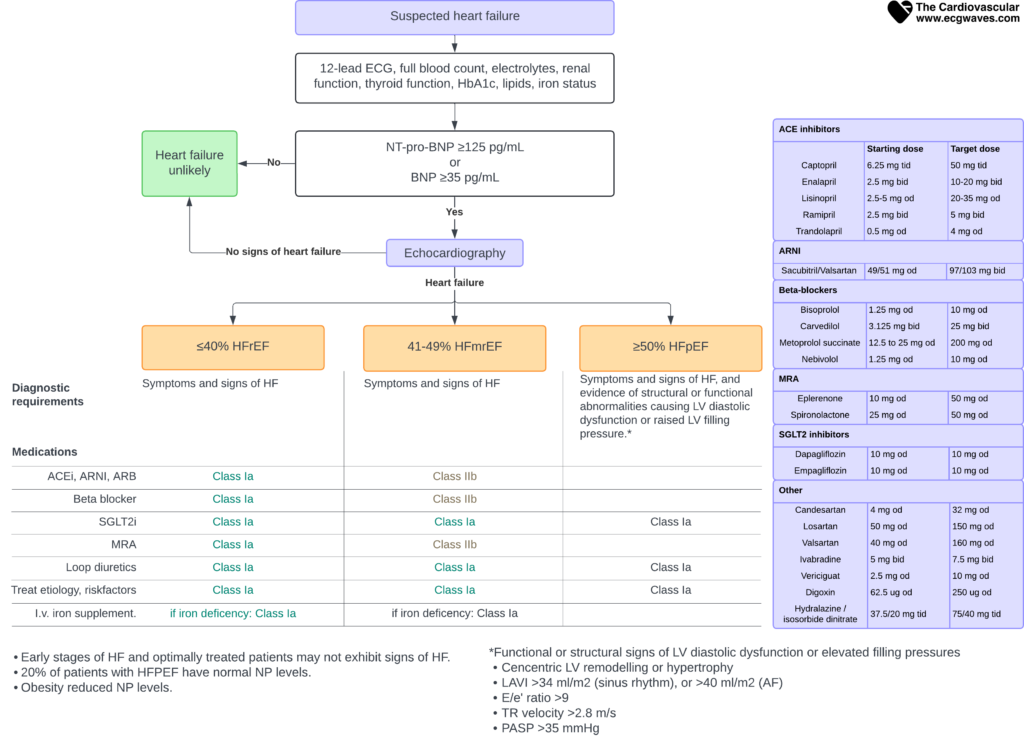
Un ECG strictement normal rend le diagnostic d’insuffisance cardiaque très peu probable (valeur prédictive négative > 90%). Si l’ECG est anormal ou en cas de forte suspicion clinique, le dosage des peptides natriurétiques est l’étape suivante.
Dosage du NT-proBNP et du BNP
Les peptides natriurétiques sont sécrétés par le myocarde en réponse à l’étirement pariétal. Ils ont une excellente valeur prédictive négative pour exclure l’insuffisance cardiaque.
Tableau 4. Seuils décisionnels pour le NT-proBNP et le BNP
| Biomarqueur | Seuil d’exclusion (Insuffisance Cardiaque peu probable si <) |
|---|---|
| Contexte non aigu (Ambulatoire) | |
| NT-proBNP | 125 pg/mL |
| BNP | 35 pg/mL |
| Contexte aigu (Urgences/Dyspnée aiguë) | |
| NT-proBNP | 300 pg/mL |
| BNP | 100 pg/mL |
Attention aux faux positifs (âge, FA, insuffisance rénale) et aux faux négatifs (obésité, péricardite constrictive). En cas de positivité, l’échocardiographie est indispensable pour confirmer le diagnostic et phénotyper l’IC.
L’échocardiographie
«
L’échocardiographie Doppler est l’examen clé. Elle permet de :
- Mesurer la FEVG pour classer le patient (HFrEF, HFmrEF, HFpEF).
- Évaluer la fonction diastolique (flux transmitral, Doppler tissulaire E/e’, taille de l’oreillette gauche).
- Rechercher la cause : anomalie valvulaire, trouble de la cinétique segmentaire (ischémie), hypertrophie.
- Estimer les pressions de remplissage et la pression artérielle pulmonaire (PAPS).
IRM cardiaque
L’IRM est le « gold standard » pour l’analyse structurelle et fonctionnelle. Elle est particulièrement utile pour l’étiologie (rehaussement tardif pour voir la fibrose ou les cicatrices d’infarctus, diagnostic d’amylose, de sarcoïdose ou de myocardite).
Traitement de l’insuffisance cardiaque
La prise en charge moderne de l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF) repose sur l’administration rapide des « Quatre Piliers » thérapeutiques qui ont démontré une réduction de la mortalité et des hospitalisations.
Traitement de l’HFrEF (FEVG ≤ 40%)

Les recommandations actuelles préconisent d’initier les quatre classes suivantes le plus rapidement possible (simultanément ou en succession rapide), plutôt que d’attendre de titrer chaque médicament à sa dose maximale avant d’introduire le suivant.
1. Diurétiques de l’anse
- Essentiels pour le traitement symptomatique de la congestion (dyspnée, œdèmes). Ils n’ont pas d’effet prouvé sur la mortalité mais sont indispensables pour la stabilité clinique.
- Le Furosémide est le plus utilisé. La dose doit être ajustée pour maintenir le patient « sec » (euvolémique).
2. Inhibiteurs du SGLT2 (Gliflozines)
Initialement développés comme antidiabétiques, ces médicaments ont révolutionné le traitement de l’insuffisance cardiaque. La Dapagliflozine et l’Empagliflozine sont recommandées (Classe I) chez tous les patients atteints d’HFrEF, qu’ils soient diabétiques ou non.
- Ils réduisent significativement la mortalité cardiovasculaire et le risque d’hospitalisation.
- Le mécanisme inclut la natriurèse, l’amélioration de l’énergétique myocardique et la protection rénale.
- Avantage : Dose unique, pas besoin de titration progressive, bien tolérés (faible risque d’hypotension).
- Contre-indication : Insuffisance rénale sévère (DFG < 20-25 ml/min selon la molécule).
| Inhibiteur SGLT2 | Dose unique journalière (mg) |
|---|---|
| Dapagliflozine (Forxiga) | 10 mg |
| Empagliflozine (Jardiance) | 10 mg |
3. Bêta-bloquants
«
- Pilar du traitement, ils bloquent l’activation sympathique chronique. Réduisent la mortalité de ~35 %.
- Doivent être titrés progressivement jusqu’à la dose cible ou maximale tolérée.
- Molécules validées dans l’IC : Bisoprolol, Carvédilol, Métoprolol succinate, Nébivolol.
4. ARNI / IEC / ARA
- ARNI (Sacubitril/Valsartan) : Recommandé en remplacement des IEC pour réduire davantage la morbidité et la mortalité (étude PARADIGM-HF). Peut être utilisé en première intention chez les patients hospitalisés (étude PIONEER-HF).
- IEC (Inhibiteurs de l’ECA) : Enalapril, Ramipril, etc. Restent le standard si l’ARNI n’est pas disponible ou toléré.
- ARA (Sartans) : Alternative en cas d’intolérance aux IEC (toux).
5. Antagonistes des Minéralocorticoïdes (ARM)
- Spironolactone ou Eplérénone. Recommandés chez tous les patients symptomatiques (FEVG ≤ 35%) malgré un traitement par BB et IEC.
- Surveillance stricte de la kaliémie et de la fonction rénale requise.
Autres traitements pharmacologiques
- Ivabradine : Si rythme sinusal, FEVG ≤ 35% et FC ≥ 70-75 bpm malgré bêta-bloquants à dose optimale.
- Vericiguat : Stimulateur de la guanylate cyclase soluble, pour les patients s’aggravant malgré le traitement optimal.
- Digoxine : En cas de FA rapide ou symptômes persistants, pour réduire les hospitalisations (pas d’effet sur la mortalité).
- Fer intraveineux (Carboxymaltose ferrique) : Recommandé chez les patients symptomatiques avec carence martiale (Ferritine < 100 ou 100-299 avec TSAT < 20%) pour améliorer les symptômes et réduire les réhospitalisations.
Traitement de l’HFpEF (FEVG ≥ 50%) et HFmrEF
Les connaissances ont considérablement évolué. Contrairement aux années précédentes, nous disposons désormais de thérapies prouvées.
- Inhibiteurs du SGLT2 (Empagliflozine, Dapagliflozine) : C’est la seule classe thérapeutique ayant reçu une recommandation de Classe I pour l’HFpEF et l’HFmrEF. Ils réduisent le risque de décès cardiovasculaire ou d’hospitalisation pour insuffisance cardiaque (études EMPEROR-Preserved et DELIVER).
- Diurétiques : Pour soulager les signes de congestion.
- Gestion des comorbidités : Contrôle strict de l’hypertension artérielle, traitement de la fibrillation atriale, perte de poids, gestion du diabète.
- Les ARNI, les ARA et les ARM peuvent être envisagés (Classe IIb) dans certains cas d’HFmrEF ou HFpEF pour réduire les hospitalisations.
Traitement par dispositifs implantables
Thérapie de resynchronisation cardiaque (CRT)
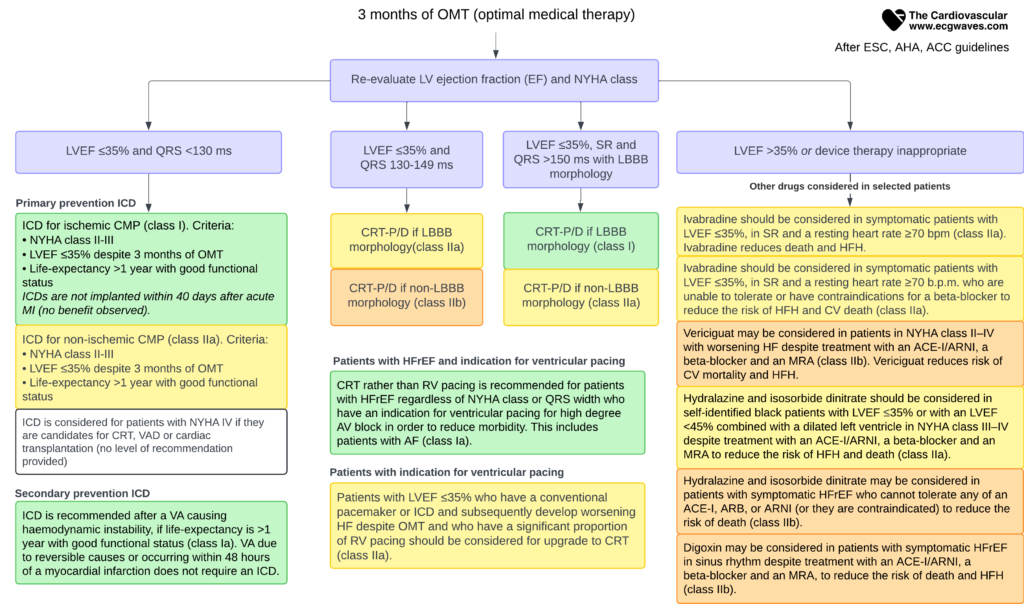
La CRT (pacemaker biventriculaire) est indiquée chez les patients symptomatiques malgré un traitement optimal, ayant une FEVG ≤ 35% et des complexes QRS larges (bloc de branche gauche, LBBB). Elle permet de resynchroniser la contraction des ventricules, améliorant la fonction pompe et la survie. Plus le QRS est large (> 150 ms) et de morphologie retard gauche, plus le bénéfice est grand.
Défibrillateur cardiaque implantable (DAI)
Le DAI est indiqué en prévention primaire de la mort subite chez les patients avec une FEVG ≤ 35% (NYHA II-III) malgré au moins 3 mois de traitement médical optimal, si l’espérance de vie est > 1 an. Le bénéfice est mieux établi dans les cardiopathies ischémiques que non ischémiques.
Références
Nabel EG, Braunwald E. A Tale of Coronary Artery Disease and Myocardial Infarction. New England Journal of Medicine. 2012;366(1):54-63.
McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021;42(36):3599–3726.
Heidenreich PA, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Am Coll Cardiol. 2022;79(17):e263-e421.
McMurray JJ, Packer M, Desai AS, et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure. New England Journal of Medicine. 2014;371(11):993-1004.
Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure (EMPEROR-Reduced). N Engl J Med. 2020;383:1413-1424.
McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction (DAPA-HF). N Engl J Med. 2019;381:1995-2008.
Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction (EMPEROR-Preserved). N Engl J Med. 2021;385:1451-1461.
Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction (DELIVER). N Engl J Med. 2022;387:1089-1098.
Savarese G, Lund LH. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 2017;3(1):7-11.
Stewart S, Ekman I, Ekman T, Oden A, Rosengren A. Population Impact of Heart Failure and the Most Common Forms of Cancer. Circulation : Cardiovascular Quality and Outcomes. 2010;3(6):573-580.