Mécanique du myocarde : Structure et fonction des fibres myocardiques
Structure et fonction contractile des fibres myocardiques
La paroi du ventricule gauche est une structure complexe et hautement organisée, pouvant être subdivisée en plusieurs couches distinctes. Ces couches présentent des similitudes histologiques avec celles observées dans les artères du système circulatoire (figure 1). La paroi ventriculaire est constituée d’un revêtement interne (endocarde), d’une couche musculaire épaisse assurant la fonction contractile (myocarde) et d’un revêtement externe (épicarde). Ces couches sont analogues à la tunique intima, à la tunique moyenne (média) et à la tunique adventice, respectivement.
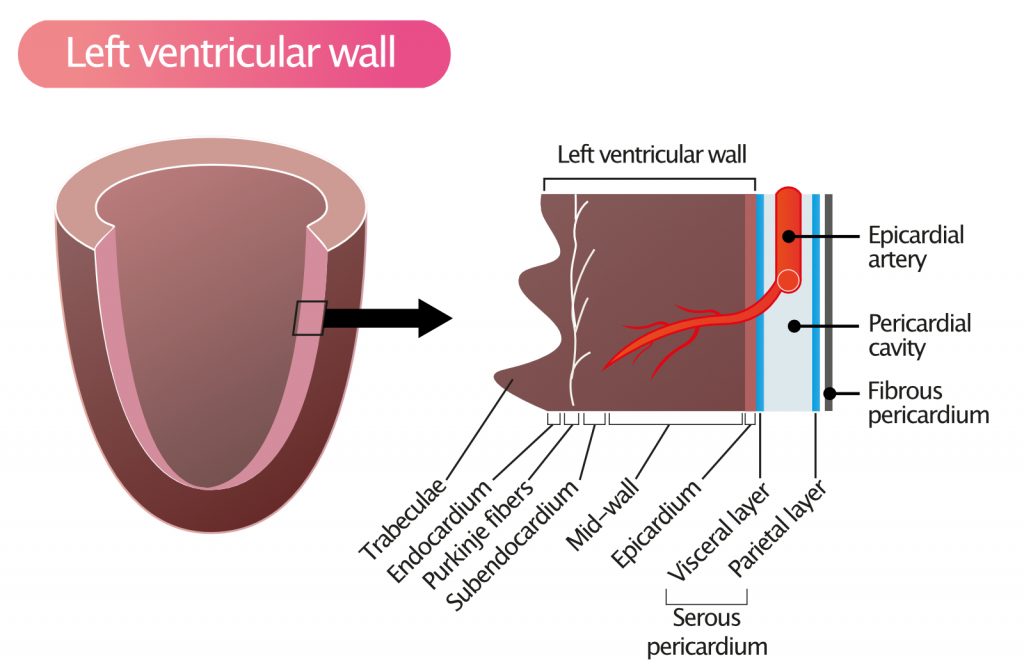
L’endocarde
L’endocarde est la fine membrane interne qui tapisse les oreillettes, les ventricules et forme la surface des valves cardiaques. Fonctionnellement et structurellement comparable à l’endothélium vasculaire, l’endocarde repose sur une membrane basale sous-jacente et une fine couche de tissu conjonctif lâche, riche en fibres élastiques et en collagène. L’endocarde est en continuité directe avec l’endothélium des grands vaisseaux (aorte, artère pulmonaire, veines caves et pulmonaires).
Il joue un rôle crucial en offrant une surface lisse pour prévenir la thrombose intracavitaire. De plus, dans les ventricules, la couche sous-endocardique abrite les cellules du réseau de Purkinje, responsables de la conduction rapide de l’influx électrique.
L’épicarde
La couche la plus externe de la paroi ventriculaire est l’épicarde, qui correspond anatomiquement au feuillet viscéral du péricarde séreux. Il est constitué de tissu conjonctif fibroélastique et de cellules mésothéliales. L’épicarde abrite les artères coronaires épicardiques, les veines cardiaques, les lymphatiques et une quantité variable de tissu adipeux qui entoure et protège ces structures vasculaires.
Le myocarde
L’épaisse couche musculaire située entre l’endocarde et l’épicarde est appelée myocarde. C’est le tissu responsable du travail mécanique du cœur. Il contient principalement des cardiomyocytes (fibres musculaires cardiaques), mais aussi une matrice extracellulaire de tissu conjonctif (collagène), des fibroblastes et une très forte densité de capillaires (environ un capillaire par myocyte), indispensable pour répondre aux besoins métaboliques élevés du cœur.
Ultrastructure et syncytium fonctionnel
Les cardiomyocytes sont des cellules striées, riches en mitochondries, dont l’unité contractile fondamentale est le sarcomère. Les fibres musculaires sont connectées entre elles par des structures spécialisées appelées disques intercalaires. Ces disques contiennent des desmosomes (assurant la cohésion mécanique) et des jonctions communicantes (gap junctions). Ces dernières permettent le passage rapide des ions d’une cellule à l’autre, assurant une propagation quasi instantanée du potentiel d’action. Le myocarde se comporte ainsi comme un syncytium fonctionnel, se contractant de manière coordonnée.
Vulnérabilité du sous-endocarde
Le sous-endocarde est la couche musculaire la plus profonde du myocarde, immédiatement adjacente à l’endocarde. D’un point de vue physiopathologique, c’est la zone la plus vulnérable.
En cas d’ischémie myocardique, le sous-endocarde présente les conditions les plus défavorables pour deux raisons principales : il est soumis aux pressions pariétales les plus élevées (stress systolique) et sa perfusion est quasi-exclusivement diastolique, contrairement aux couches épicardiques qui conservent une perfusion systolique partielle. Par conséquent, tous les infarctus du myocarde débutent dans le sous-endocarde et s’étendent vers l’épicarde (front d’onde de nécrose). Les infarctus n’affectant que cette couche (infarctus sous-endocardique) sont souvent causés par des occlusions subtotales ou transitoires de l’artère coronaire. Ce point est crucial pour comprendre la distinction entre STEMI et NSTEMI, abordée en détail dans le chapitre NSTEMI (infarctus du myocarde sans sus-décalage du segment ST).
Orientation des fibres myocardiques et mécanique ventriculaire
L’architecture du ventricule gauche n’est pas une simple juxtaposition de cellules, mais une structure tridimensionnelle complexe souvent décrite comme une bande musculaire unique enroulée en double hélice. L’orientation des fibres myocardiques varie progressivement de l’endocarde vers l’épicarde, ce qui permet au ventricule gauche de se contracter de manière très sophistiquée et énergétiquement efficace.
- Fibres sous-endocardiques (hélice dextrogyre) : Les fibres musculaires adjacentes à l’endocarde sont orientées longitudinalement (parallèles au grand axe). Leur contraction entraîne un raccourcissement longitudinal, tirant l’anneau mitral vers l’apex (figure 2A). C’est ce mouvement qui est mesuré par le déplacement de l’anneau mitral (MAPSE) ou l’onde S’ tissulaire.
- Fibres médio-murales (circulaires) : Les fibres de la couche médiane (paroi médiane) sont orientées circulairement autour de l’axe court. La contraction de cette couche agit comme un sphincter et entraîne un raccourcissement radial, réduisant le diamètre de la cavité ventriculaire (figure 2B).
- Fibres sous-épicardiques (hélice lévogyre) : Les fibres musculaires adjacentes à l’épicarde sont orientées obliquement, à environ 60° par rapport aux fibres de la paroi médiane et de manière opposée aux fibres sous-endocardiques. La contraction de cette couche entraîne un mouvement de torsion (twist) de l’ensemble du ventricule.
Les segments basaux effectuent une rotation dans le sens des aiguilles d’une montre (vue apicale), tandis que l’apex effectue une rotation dans le sens inverse des aiguilles d’une montre. Cette contraction en torsion opposée est appelée raccourcissement circonférentiel (figure 2C) et peut être comparée au mouvement d’essorage d’une serviette humide.

Les raccourcissements longitudinal, radial et circonférentiel se produisent simultanément. Il en résulte une cinétique complexe où le plan auriculo-ventriculaire (AV) est tiré vers l’apex (lui-même relativement fixe par rapport au diaphragme via le péricarde), tandis que le myocarde s’épaissit vers le centre de la cavité et que l’ensemble du ventricule subit une torsion. En outre, tout le myocarde s’épaissit considérablement pendant la contraction (épaississement systolique), ce qui réduit encore le volume de la cavité et comprime le sang pour l’éjecter dans l’aorte. La contraction longitudinale, la contraction radiale, la contraction circonférentielle et l’épaississement du myocarde sont des paramètres clés évalués à l’aide de l’échocardiographie standard et du Speckle Tracking.
Efficacité de l’éjection et couplage structure-fonction
Ces mécanismes géométriques permettent une contraction d’une efficacité remarquable qui maximise l’éjection du sang (figure 3). Ceci est démontré par le paradoxe apparent suivant : les fibres musculaires individuelles (sarcomères) ne se raccourcissent que d’environ 13 % à 15 % de leur longueur initiale. Pourtant, grâce à l’organisation laminaire et hélicoïdale, la somme de ces contractions entraîne une réduction du diamètre et de la longueur du ventricule de plus de 20 %, permettant d’éjecter plus de 60 % du volume télédiastolique (fraction d’éjection normale).
Si les fibres étaient toutes orientées de manière circulaire ou longitudinale simple, le cœur devrait se raccourcir de manière beaucoup plus importante pour obtenir le même volume d’éjection, ce qui serait énergétiquement insoutenable.

Rôle dans la relaxation diastolique (Recoil)
L’organisation structurelle des fibres ne sert pas uniquement l’éjection systolique, mais joue un rôle fondamental dans le remplissage diastolique. Durant la systole, la torsion du ventricule stocke de l’énergie potentielle élastique (similaire à la compression d’un ressort) dans les protéines du cytosquelette (notamment la titine) et la matrice extracellulaire.
Au tout début de la diastole, lors de la relaxation isovolumétrique, cette énergie est restituée sous forme de détorsion rapide (untwisting). Ce phénomène crée une pression intraventriculaire négative (phénomène de succion diastolique) qui aspire activement le sang de l’oreillette vers le ventricule. Une altération de la structure myocardique (fibrose, hypertrophie) ou de la perfusion (ischémie) perturbe ce mécanisme de torsion/détorsion, conduisant à une dysfonction diastolique précoce.