L’insuffisance cardiaque : Du diagnostic à la prise en charge
Insuffisance cardiaque
L’insuffisance cardiaque (IC) est un problème majeur de santé publique à l’échelle mondiale, souvent qualifiée d’épidémie cardiovasculaire du XXIe siècle. Alors que l’incidence des maladies coronariennes et des infarctus aigus du myocarde a été réduite d’environ 50 % au cours des dernières décennies grâce aux progrès de la prévention et de la revascularisation, l’incidence de l’insuffisance cardiaque est restée stable, voire en augmentation en valeur absolue du fait du vieillissement de la population. De nouvelles données suggèrent que l’incidence de l’insuffisance cardiaque chez les jeunes adultes a augmenté ces dernières années (Nabel et al., Savarese et al.). Il s’agit d’une tendance paradoxale et inquiétante, en particulier à la lumière des améliorations apportées à la prise en charge de l’hypertension (les maladies coronariennes et l’hypertension sont traditionnellement considérées comme les principaux facteurs étiologiques). On pense que le vieillissement de la population, l’amélioration de la survie post-infarctus et la prévalence accrue de l’obésité, du diabète et de la dysglycémie favorisent la pandémie d’insuffisance cardiaque. En effet, de plus en plus de données suggèrent que l’insuffisance cardiaque est désormais la complication cardiovasculaire la plus fréquente du diabète (Shah et al., McMurray et al.).
La prise en charge de l’insuffisance cardiaque a connu des révolutions thérapeutiques successives. Au cours des années 1970 et 1980, les bêta-bloquants, les inhibiteurs de l’ECA (enzyme de conversion de l’angiotensine) et les antagonistes des récepteurs de l’angiotensine (ARA) ont été introduits et ont permis d’améliorer considérablement la survie. Lorsque les pionniers Waagstein, Hjalmarsson et Swedberg ont proposé d’utiliser les bêta-bloquants – qui ont des effets inotropes et chronotropes négatifs – pour traiter l’insuffisance cardiaque, ils ont été accueillis avec scepticisme. Leurs études de référence ont prouvé que les bêta-bloquants prolongent la vie, soulagent les symptômes et réduisent le risque d’hospitalisation des patients souffrant d’insuffisance cardiaque.
Plus récemment, le paradigme du traitement a de nouveau changé avec l’avènement de la « quadruple thérapie ». En 2014, l’étude PARADIGM-HF a introduit les ARNI (inhibiteurs de l’angiotensine et de la néprilysine). Surtout, l’arrivée des inhibiteurs du SGLT2 (gliflozines) a marqué un tournant décisif, ces molécules démontrant une efficacité remarquable indépendamment de la présence d’un diabète et sur l’ensemble du spectre de la fraction d’éjection.
L’insuffisance cardiaque reste une maladie grave dont le pronostic à long terme est sombre sans traitement optimal. Le taux de survie à 5 ans après une hospitalisation pour insuffisance cardiaque est d’environ 50 à 60 %, ce qui est comparable, voire pire, à de nombreux cancers courants (Stewart et al.). En outre, l’insuffisance cardiaque est une maladie invalidante qui a un impact très négatif sur la qualité de vie. Environ la moitié des patients souffrant d’insuffisance cardiaque meurent subitement des suites d’arythmies ventriculaires (tachycardie ventriculaire, fibrillation ventriculaire), tandis que l’autre moitié décède de défaillance de pompe progressive. Un diagnostic précoce et une mise en place rapide des traitements modificateurs de la maladie (GDMT – Guideline-Directed Medical Therapy) sont impératifs.
Selon l’American Heart Association (AHA) et la Société Européenne de Cardiologie (ESC), il existe trois phénotypes d’insuffisance cardiaque : HFpEF, HFmrEF et HFrEF. Cette classification repose principalement sur la mesure de la fraction d’éjection du ventricule gauche (FEVG). Historiquement, la majorité des essais cliniques ont été réalisés sur l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF). Cependant, l’HFpEF (insuffisance cardiaque à fraction d’éjection préservée) représente désormais plus de la moitié des cas, particulièrement chez le sujet âgé et la femme. Contrairement aux idées reçues passées, nous disposons aujourd’hui de traitements efficaces (notamment les inhibiteurs du SGLT2) pour l’HFpEF et l’HFmrEF.
Tableau 1. Types d’insuffisance cardiaque (Classification ESC).
| Type d’insuffisance cardiaque | Description clinique | Fraction d’éjection (%) |
|---|---|---|
| HFrEF (Reduced) | Insuffisance cardiaque avec fraction d’éjection réduite | ≤ 40% |
| HFmrEF (Mildly Reduced) | Insuffisance cardiaque avec fraction d’éjection modérément réduite | 41-49% |
| HFpEF (Preserved) | Insuffisance cardiaque avec fraction d’éjection préservée | ≥ 50% |
«
Dans l’insuffisance cardiaque avec fraction d’éjection réduite (HFrEF), la fonction systolique du ventricule gauche est altérée, entraînant un défaut de vidange ventriculaire. Dans la HFpEF, le problème principal réside dans un défaut de remplissage (dysfonction diastolique) et une rigidité myocardique accrue, bien que des anomalies subtiles de la fonction systolique longitudinale soient souvent présentes. Il existe des signes cliniques d’insuffisance cardiaque malgré une fraction d’éjection normale (FE ≥ 50 %). Dans l’HFmrEF, le phénotype est souvent intermédiaire, ressemblant davantage à une HFrEF légère qu’à une véritable HFpEF.
Les mécanismes à l’origine de la HFpEF sont complexes et hétérogènes, impliquant une inflammation systémique, une dysfonction endothéliale microvasculaire et une fibrose. Pratiquement tous les patients atteints d’HFpEF présentent une dysfonction diastolique significative.
La majorité des patients souffrant d’insuffisance cardiaque présentent une comorbidité importante (« multimorbidité »). La cardiopathie ischémique, l’infarctus du myocarde, l’hypertension, la fibrillation atriale, les maladies pulmonaires (BPCO), les maladies rénales chroniques, le diabète et la carence martiale sont des affections coexistantes courantes. Le syndrome cardio-rénal est une combinaison particulièrement délétère, où la dysfonction d’un organe précipite ou aggrave la dysfonction de l’autre.
Épidémiologie de l’insuffisance cardiaque
- L’insuffisance cardiaque touche environ 1 à 2 % de la population adulte dans les pays développés.
- La prévalence augmente fortement avec l’âge, atteignant plus de 10 % chez les personnes âgées de 70 ans ou plus.
- 6,5 millions d’adultes aux États-Unis et plus de 15 millions en Europe souffrent d’insuffisance cardiaque.
- L’insuffisance cardiaque est la première cause d’hospitalisation chez les patients de plus de 65 ans.
- Le risque de développer une insuffisance cardiaque au cours de sa vie est de 20 % pour une personne de 40 ans (risque à vie).
- Alors que l’incidence de l’HFrEF tend à se stabiliser, celle de l’HFpEF continue d’augmenter, en lien avec les comorbidités métaboliques et le vieillissement.
- Le diabète double à quadruple le risque d’IC, indépendamment des autres facteurs de risque (cardiomyopathie diabétique).
Pronostic
Malgré les progrès thérapeutiques, le pronostic reste sévère, souvent pire que celui de nombreux cancers (hors cancer du poumon ou du pancréas). Les réhospitalisations sont fréquentes et constituent un marqueur de mauvais pronostic.
Tableau 2. Survie à long terme après une hospitalisation pour insuffisance cardiaque.
| Temps écoulé depuis l’hospitalisation | Survie estimée (%) |
|---|---|
| 1 an | 70 – 75 % |
| 5 ans | 50 – 60 % |
«
Causes de l’insuffisance cardiaque
Mécanismes fondamentaux
L’insuffisance cardiaque peut être la voie finale commune de nombreuses pathologies cardiovasculaires. On distingue classiquement :
- Maladie du myocarde (Cardiomyopathies) : ischémique, toxique, génétique, infiltrative.
- Surcharge de pression : hypertension artérielle, sténose aortique.
- Surcharge de volume : insuffisances valvulaires (mitrale, aortique), shunts intracardiaques.
- Arythmies : tachycardiomyopathies ou bradycardies sévères.
- Gêne au remplissage : péricardite constrictive, cardiomyopathie restrictive.
Chapitre connexe : Cardiomyopathie induite par la tachycardie.
Maladie coronarienne et infarctus du myocarde
L’infarctus du myocarde (STEMI, NSTEMI) est la cause la plus fréquente d’HFrEF (environ 50-60% des cas). La perte de masse contractile (nécrose) et le remodelage post-infarctus entraînent une dilatation ventriculaire. L’ischémie chronique (« myocarde hibernant ») peut également causer une dysfonction ventriculaire gauche réversible après revascularisation.
L’hypertension artérielle
L’hypertension est un facteur de risque majeur, particulièrement pour l’HFpEF. Elle impose une augmentation chronique de la postcharge. Le ventricule gauche réagit par une hypertrophie concentrique (HVG) pour normaliser la contrainte pariétale. Cette HVG entraîne une altération de la relaxation (dysfonction diastolique) et, à terme, peut évoluer vers une dilatation et une dysfonction systolique (« Burn-out » de l’hypertension).
Le diabète et la cardiomyopathie diabétique
Le diabète est une cause indépendante d’IC. La cardiomyopathie diabétique se développe en l’absence de maladie coronarienne ou d’hypertension significative. Elle est médiée par l’hyperglycémie, l’insulinorésistance, la lipotoxicité, les produits terminaux de glycation avancée (AGEs) et la fibrose interstitielle.
Arythmies et cardiomyopathie rythmique
La fibrillation atriale (FA) et l’insuffisance cardiaque sont intimement liées (« les fausses jumelles »). La FA peut être la cause de l’IC (tachycardiomyopathie, perte de la contribution atriale au remplissage) ou sa conséquence (dilatation de l’oreillette gauche due aux pressions élevées). Le contrôle du rythme ou de la fréquence est crucial.
Valvulopathies
Les valvulopathies, qu’elles soient sténotiques (obstacle à l’éjection ou au remplissage) ou fuyantes (surcharge volumétrique), conduisent inévitablement à l’IC si elles ne sont pas traitées chirurgicalement ou par voie percutanée (TAVI, MitraClip).
Cardiotoxicité et causes toxiques
Alcool et drogues
La cardiomyopathie alcoolique est une forme de cardiomyopathie dilatée potentiellement réversible à l’arrêt complet de l’intoxication. La cocaïne et les amphétamines sont également des causes de plus en plus fréquentes de cardiomyopathie aiguë et chronique.
Chimiothérapies et immunothérapies
La cardio-oncologie est une discipline en plein essor. Outre les anthracyclines (Doxorubicine), les thérapies ciblées (Trastuzumab, inhibiteurs de tyrosine kinase) et les inhibiteurs de points de contrôle immunitaire (Check-point inhibitors provoquant des myocardites fulminantes) nécessitent une surveillance étroite.
Causes génétiques (Cardiomyopathies familiales)
Environ 30 à 40 % des cardiomyopathies dilatées « idiopathiques » ont une origine génétique (mutations de la Titine, des lamines A/C, de la chaîne lourde de myosine). Le diagnostic génétique est important pour le dépistage familial et parfois pour le pronostic (ex: laminopathies à haut risque arythmique).
Autres étiologies
- Infiltrations : Amylose cardiaque (à transthyrétine – ATTR ou chaînes légères – AL) est une cause sous-diagnostiquée d’HFpEF chez le sujet âgé. La Sarcoïdose cardiaque doit être évoquée devant des troubles de conduction chez le sujet jeune.
- Maladies de surcharge : Hémochromatose (Fer), Maladie de Fabry.
- Myocardites : Virales (Parvovirus B19, Coxsackie, COVID-19), auto-immunes (Lupus, myocardite à cellules géantes).
- Péripartum : Cardiomyopathie du péripartum (PPCM), urgence diagnostique.
- Haut débit : Thyrotoxicose, anémie sévère, fistules artério-veineuses, carence en thiamine (Béribéri).
Remodelage cardiaque
Le remodelage cardiaque est le processus central de la progression de l’HFrEF. Il se définit par des modifications génomiques, moléculaires, cellulaires et interstitielles qui se traduisent cliniquement par des changements de taille, de forme (sphéricité) et de fonction du cœur. Initialement adaptatif, ce processus devient délétère, entretenu par l’activation neuro-hormonale (Système Rénine-Angiotensine-Aldostérone et Système Sympathique).
L’objectif fondamental du traitement pharmacologique (les « 4 piliers ») est de bloquer ces systèmes neuro-hormonaux pour induire un remodelage inverse (récupération de la fonction et réduction des volumes ventriculaires).
Symptômes de l’insuffisance cardiaque
Les symptômes cardinaux résultent de deux mécanismes : la congestion (rétention hydrosodée en amont) et le bas débit (hypoperfusion en aval).
Symptômes typiques (Haute spécificité)
- Dyspnée d’effort : Progressive, classée selon la NYHA.
- Orthopnée : Dyspnée de décubitus nécessitant de surélever la tête avec plusieurs oreillers. C’est un signe très spécifique de congestion pulmonaire.
- Dyspnée paroxystique nocturne (DPN) : Réveil brutal par une sensation d’étouffement, obligeant le patient à s’asseoir ou à ouvrir la fenêtre.
- Intolérance à l’effort et fatigabilité musculaire (liée au bas débit).
- Œdèmes des membres inférieurs (OMI) : Bilatéraux, déclives, prenant le godet.
Symptômes moins typiques
- Toux nocturne sèche.
- Sibilances (asthme cardiaque).
- Sensation de ballonnement abdominal (ascite, hépatalgie), perte d’appétit (congestion intestinale).
- Confusion, troubles cognitifs (hypoperfusion cérébrale), surtout chez le sujet âgé.
- Bendopnée (essoufflement en se penchant en avant, ex: pour faire ses lacets).
Symptômes de l’insuffisance cardiaque aiguë décompensée
La décompensation aiguë est une urgence vitale. Elle peut se présenter sous forme d’œdème aigu du poumon (OAP) ou de choc cardiogénique. La figure 1 présente les symptômes typiques.

Classification fonctionnelle NYHA
La classification NYHA reste le standard pour évaluer la sévérité fonctionnelle et guider la thérapeutique.
Tableau 3. Classification fonctionnelle de l’insuffisance cardiaque selon la New York Heart Association (NYHA)
| Classe NYHA | Description clinique |
|---|---|
| I | Aucune limitation de l’activité physique. L’activité physique ordinaire ne provoque pas de fatigue excessive, de palpitations ou de dyspnée. (Asymptomatique). |
| II | Légère limitation de l’activité physique. Confortable au repos. L’activité physique ordinaire entraîne une fatigue, des palpitations, une dyspnée. (Symptômes à l’effort ordinaire). |
| III | Limitation marquée de l’activité physique. Confortable au repos. Une activité inférieure à l’ordinaire entraîne des symptômes. (Symptômes au moindre effort). |
| IV | Incapable d’exercer une activité physique sans gêne. Symptômes d’insuffisance cardiaque présents même au repos. Gêne augmentée par toute activité. |
Signes cliniques de l’insuffisance cardiaque
L’examen physique recherche des signes de congestion (droite et gauche) et de bas débit.
«
- Turgescence jugulaire et reflux hépato-jugulaire : Signes très spécifiques d’élévation de la pression auriculaire droite et de congestion veineuse centrale.
- Troisième bruit cardiaque (B3) : « Galop protodiastolique ». Signe de remplissage ventriculaire rapide et pathologique, très spécifique d’une dysfonction systolique et d’une élévation des pressions de remplissage.
- Choc de pointe (apex) déplacé : Vers la gauche et le bas, signe de dilatation ventriculaire gauche.
- Râles crépitants : À l’auscultation pulmonaire (bases), signe d’œdème alvéolaire ou interstitiel.
- Matité à la percussion : En cas d’épanchement pleural (hydrothorax), souvent à droite.
- Hépatomégalie douloureuse (foie cardiaque) et ascite.
- Signes de bas débit : Extrémités froides, marbrures (genoux), hypotension, pincement de la pression pulsée (Pression artérielle différentielle réduite), oligurie, tachycardie de repos.
Démarche diagnostique de l’insuffisance cardiaque
Algorithme diagnostique de l’IC chronique
Le diagnostic ne repose pas sur un seul test mais sur un faisceau d’arguments. L’algorithme standard recommandé par l’ESC est le suivant :
- 1. Probabilité clinique : Antécédents (IDM, HTA), Symptômes, Signes physiques, ECG anormal.
- 2. Biologie : Dosage des peptides natriurétiques (BNP ou NT-proBNP).
- 3. Imagerie : Échocardiographie transthoracique (ETT) pour confirmation et typage.
Figure 2. Évaluation des patients présentant des symptômes ou des signes d’insuffisance cardiaque.
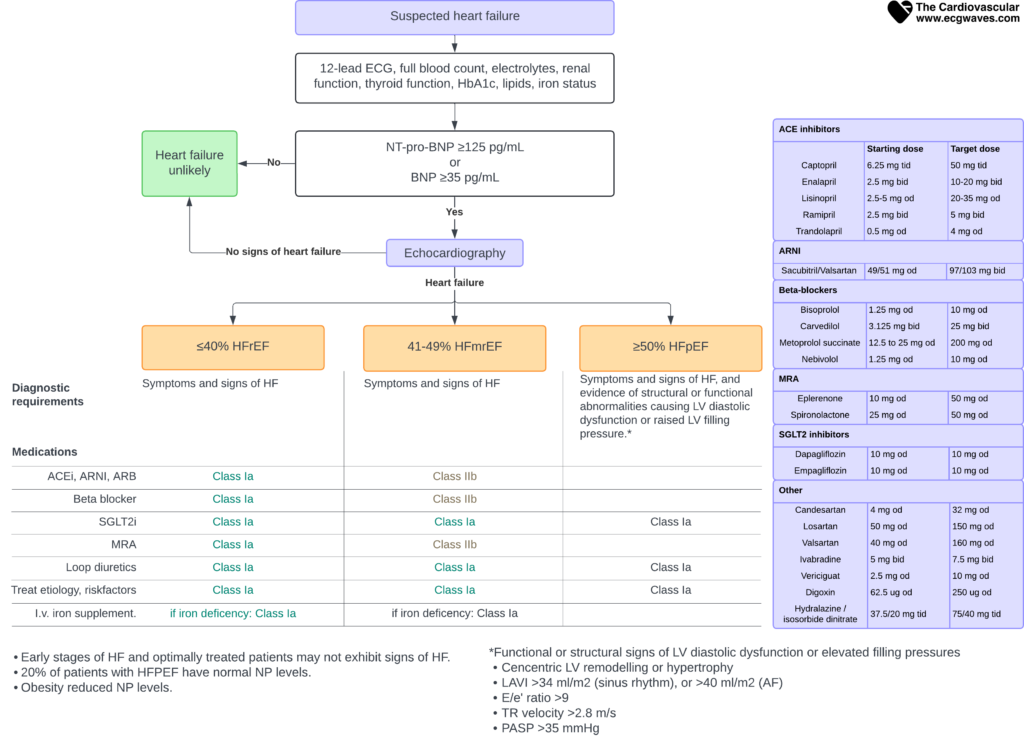
Valeur prédictive négative élevée : Si le NT-proBNP (< 125 pg/mL) ou le BNP (< 35 pg/mL) sont normaux et l'ECG est normal, l'insuffisance cardiaque est très peu probable.
Interprétation des peptides natriurétiques (BNP et NT-proBNP)
Les peptides natriurétiques sont sécrétés par les cardiomyocytes en réponse à l’étirement pariétal (tension). Ils ont des propriétés diurétiques, natriurétiques et vasodilatatrices.
Tableau 4. Seuils décisionnels pour le NT-proBNP et le BNP
| Contexte clinique | Biomarqueur | Seuil d’exclusion (Règle “Out”) |
|---|---|---|
| Ambulatoire (IC chronique) | NT-proBNP | < 125 pg/mL |
| BNP | < 35 pg/mL | |
| Urgences (IC aiguë) | NT-proBNP | < 300 pg/mL |
| BNP | < 100 pg/mL |
Il est crucial de connaître les facteurs confondants. L’obésité peut faussement abaisser les taux (déficit relatif). L’âge, l’insuffisance rénale et la fibrillation atriale augmentent les taux de base.
Tableau 5. Causes d’élévation des peptides natriurétiques hors IC
| CAUSES CARDIAQUES |
| Fibrillation auriculaire (FA) |
| Syndrome coronarien aigu |
| Embolie pulmonaire (Cœur pulmonaire aigu) |
| Hypertrophie ventriculaire gauche (HVG) |
| Myocardite, périmyocardite |
| CAUSES NON CARDIAQUES |
| Insuffisance rénale (surtout NT-proBNP) |
| Âge avancé |
| AVC ischémique ou hémorragique |
| Sepsis sévère, brûlures étendues |
L’ECG dans l’insuffisance cardiaque
L’ECG est rarement normal dans l’IC (valeur prédictive négative > 90%). On recherche :
- Ondes Q de nécrose (étiologie ischémique).
- Hypertrophie ventriculaire gauche.
- Fibrillation atriale.
- Largeur du QRS (Bloc de branche gauche) : déterminant pour la thérapie de resynchronisation (CRT).
L’échocardiographie Doppler (ETT)
«
C’est l’examen clé. Il permet de :
- Mesurer la FEVG (Simpson biplan) pour classer l’IC.
- Évaluer la fonction diastolique (flux mitral, DTI à l’anneau, volume de l’OG, pressions pulmonaires).
- Identifier l’étiologie (akinésie segmentaire, valvulopathie, péricardite).
- Estimer les pressions de remplissage et la pression artérielle pulmonaire (PAPS).
- Mesurer le débit cardiaque et le volume d’éjection systolique.
Traitement de l’insuffisance cardiaque
Objectifs et stratégie globale
La prise en charge de l’HFrEF a été bouleversée ces dernières années. On ne parle plus d’introduction séquentielle lente, mais de l’instauration rapide des « 4 Piliers » (ou Quadruple Thérapie) qui ont tous démontré une réduction de la mortalité cardiovasculaire et des hospitalisations. Ces 4 classes doivent être introduites le plus tôt possible (idéalement avant la sortie d’hospitalisation).
Traitement de l’IC à fraction d’éjection réduite (HFrEF)

1. Inhibiteurs du SGLT2 (Gliflozines)
Les inhibiteurs du co-transporteur sodium-glucose de type 2 (iSGLT2) constituent la plus grande avancée récente en cardiologie. Initialement antidiabétiques, ils sont recommandés (Classe I) chez tous les patients atteints d’IC symptomatique (HFrEF), qu’ils soient diabétiques ou non.
- Mécanisme : Ils induisent une glycosurie et une natriurèse, mais leurs bénéfices cardiaques sont liés à l’amélioration de l’énergétique myocardique, la réduction de la précharge/postcharge et des effets anti-fibrosants/néphroprotecteurs.
- Bénéfice : Réduction rapide et significative de la mortalité cardiovasculaire et des hospitalisations pour IC.
- Facilité d’emploi : Pas de titration nécessaire (dose unique), peu d’effets sur la pression artérielle, faible risque d’hypoglycémie (chez le non-diabétique).
- Précaution : Hygiène génitale (risque d’infections mycosiques), surveillance rare de l’acidocétose euglycémique.
Tableau 5b. Inhibiteurs du SGLT2
| Molécule | Dose unique journalière (mg) |
|---|---|
| Dapagliflozine | 10 mg × 1 |
| Empagliflozine | 10 mg × 1 |
2. Bêta-bloquants
- Pierre angulaire du traitement, ils contrent l’hyperactivation sympathique chronique délétère.
- Réduction de la mortalité de ~35 %.
- Doivent être initiés chez le patient euvolémique (décongestionné).
Tableau 9. Bêta-bloquants validés dans l’IC
| Bêta-bloquant | Dose initiale (mg) | Dose cible (mg) |
|---|---|---|
| Bisoprolol | 1,25 × 1 | 10 × 1 |
| Carvédilol | 3,125 × 2 | 25-50 × 2 |
| Succinate de métoprolol | 12,5-25 × 1 | 200 × 1 |
| Nébivolol (surtout sujets âgés) | 1,25 × 1 | 10 × 1 |
3. Antagonistes des Minéralocorticoïdes (ARM)
«
- Recommandés chez tous les patients symptomatiques (FE < 35-40%) en plus des BB et IEC/ARNI.
- Réduisent la fibrose myocardique et le risque de mort subite.
- Surveillance stricte de la kaliémie et de la fonction rénale (créatinine) requise.
| Dose initiale (mg) | Dose cible (mg) | |
|---|---|---|
| Spironolactone | 25 × 1 | 50 × 1 |
| Éplérénone (plus sélectif) | 25 × 1 | 50 × 1 |
4. ARNI (Sacubitril/Valsartan) ou IEC/ARA
Le Sacubitril/Valsartan (ARNI) est désormais recommandé comme traitement de première intention (à la place des IEC) selon certaines directives, ou comme remplacement des IEC si le patient reste symptomatique. Il associe le blocage du SRAA (Valsartan) et l’inhibition de la néprilysine (Sacubitril), augmentant les taux de peptides natriurétiques bénéfiques.
- Supérieur à l’Enalapril (étude PARADIGM-HF) pour réduire la mortalité et les hospitalisations.
- Nécessite une fenêtre thérapeutique de 36h à l’arrêt d’un IEC avant introduction (risque d’angio-œdème). Pas de délai pour relais après un ARA.
Si l’ARNI n’est pas disponible ou toléré (coût, hypotension), les Inhibiteurs de l’ECA (IEC) restent une alternative valide de classe I.
| ARNI | Dose initiale (mg) | Dose cible (mg) |
|---|---|---|
| Sacubitril/valsartan (Entresto) | 24/26 ou 49/51 × 2 | 97/103 × 2 |
Diurétiques de l’anse
Ils sont indispensables pour traiter la congestion (dyspnée, œdèmes) mais n’ont pas d’effet démontré sur la mortalité. Ils doivent être utilisés à la dose minimale efficace pour maintenir le patient à « poids sec ». Le Furosémide, le Bumétanide et le Torasémide sont les plus utilisés.
Autres traitements pharmacologiques de l’HFrEF
- Ivabradine : Si rythme sinusal, FE ≤ 35% et FC ≥ 70-75 bpm malgré bêta-bloquant dose max.
- Vericiguat : Stimulateur de la guanylate cyclase soluble. Envisagé chez les patients s’aggravant malgré la trithérapie, ayant eu une hospitalisation récente.
- Digoxine : En dernier recours pour les symptômes ou pour ralentir une FA rapide réfractaire.
- Fer intraveineux (Carboxymaltose ferrique) : Indiqué chez les patients symptomatiques avec carence martiale (Ferritine < 100 ng/mL ou 100-299 avec saturation < 20%) pour améliorer les symptômes et réduire les réhospitalisations (Étude IRONMAN, AFFIRM-AHF).
Traitement de l’HFpEF et HFmrEF
C’est un domaine où les recommandations ont radicalement changé en 2021-2023.
- Inhibiteurs du SGLT2 (Empagliflozine, Dapagliflozine) : Ce sont les seuls médicaments ayant une recommandation de Classe I pour réduire le risque d’hospitalisation pour insuffisance cardiaque et de décès cardiovasculaire chez les patients avec FE > 40% (Études EMPEROR-Preserved et DELIVER). Ils constituent le pilier du traitement de l’HFpEF.
- Diurétiques : Recommandés pour soulager les symptômes congestifs.
- Prise en charge des comorbidités : Cruciale dans l’HFpEF (HTA, FA, ischémie, obésité).
- Les ARM (Spironolactone) et les ARNI peuvent être envisagés (Classe IIb) dans l’HFmrEF ou certains phénotypes d’HFpEF, bien que les preuves soient moins robustes que pour les iSGLT2.
Thérapies instrumentales (Défibrillateurs et Resynchronisation)
Lorsque le traitement médical optimal (OMT) pendant au moins 3 mois ne suffit pas à normaliser la FE (> 35%), l’implantation de dispositifs doit être discutée.
Thérapie de resynchronisation cardiaque (CRT)
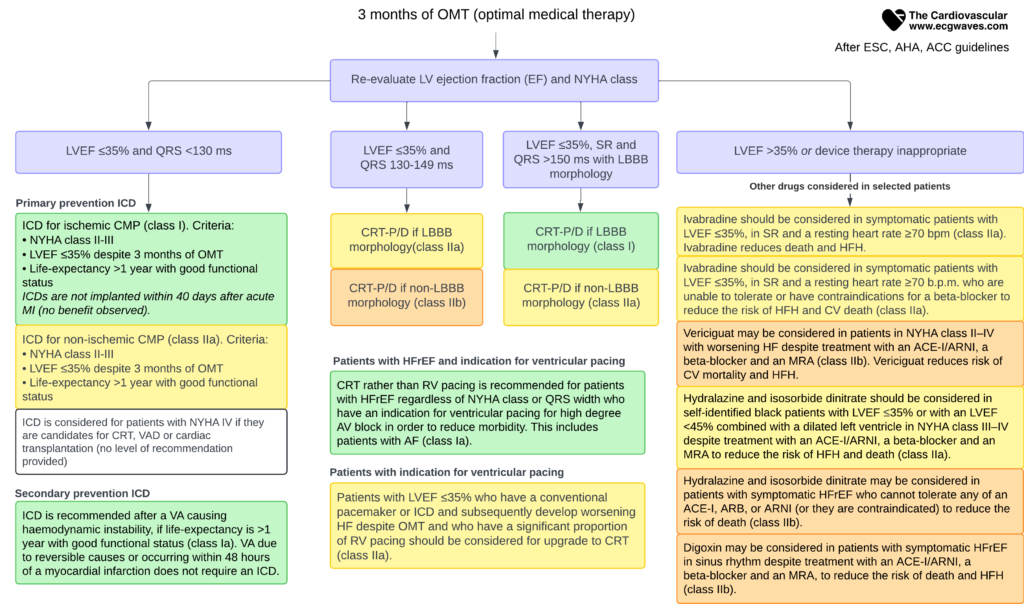
La CRT vise à corriger le désynchronisme mécanique induit par le bloc de branche gauche (BBG). Elle améliore la fonction ventriculaire, les symptômes et la survie.
- Indication idéale (Classe I) : Rythme sinusal, FEVG ≤ 35 %, Bloc de Branche Gauche (BBG) complet avec QRS ≥ 150 ms.
- Indication possible (Classe IIa/IIb) : BBG avec QRS 130-149 ms ou Non-BBG avec QRS ≥ 150 ms.
- La CRT est inutile si QRS < 130 ms.
«

Défibrillateur Automatique Implantable (DAI)
Le DAI prévient la mort subite arythmique. Il ne traite pas l’insuffisance cardiaque en soi, mais empêche le patient de décéder d’une fibrillation ventriculaire.
Indications principales
- Prévention Secondaire (Classe I) : Après un arrêt cardiaque récupéré ou une TV instable (hors cause réversible aiguë).
- Prévention Primaire (Classe I) :
- FEVG ≤ 35 %
- Classe NYHA II-III
- Sous traitement médical optimal (OMT) > 3 mois.
- Espérance de vie > 1 an.
- Origine ischémique (après 40 jours post-infarctus) ou non-ischémique (le bénéfice est plus marqué dans l’ischémique).
Fonctionnement : ATP et Chocs
Les DAI modernes utilisent la Stimulation Anti-Tachycardique (ATP) : une stimulation indolore plus rapide que la tachycardie ventriculaire (TV) pour la stopper par « overdrive pacing ». L’ATP est efficace dans > 80% des TV monomorphes, évitant ainsi un choc électrique interne douloureux. Le choc n’est délivré qu’en cas d’échec de l’ATP ou d’emblée sur une Fibrillation Ventriculaire (FV).
Références
McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021;42(36):3599-3726.
Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. Journal of the American College of Cardiology. 2022;79(17):e263-e421.
McMurray JJ, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction (DAPA-HF). New England Journal of Medicine. 2019;381(21):1995-2008.
Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure (EMPEROR-Reduced). New England Journal of Medicine. 2020;383(15):1413-1424.
Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction (EMPEROR-Preserved). New England Journal of Medicine. 2021;385(16):1451-1461.
Solomon SD, McMurray JJV, Claggett B, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction (DELIVER). New England Journal of Medicine. 2022;387(12):1089-1098.
McMurray JJ, Packer M, Desai AS, et al. Angiotensin-Neprilysin Inhibition versus Enalapril in Heart Failure (PARADIGM-HF). New England Journal of Medicine. 2014;371(11):993-1004.
Ponikowski P, Kirwan BA, Anker SD, et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure (AFFIRM-AHF): a multicentre, double-blind, randomised, controlled trial. Lancet. 2020;396(10266):1895-1904.
Savarese G, Lund LH. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 2017;3(1):7-11.
Bardy GH, Lee KL, Mark DB, et al. Amiodarone or an Implantable Cardioverter-Defibrillator for Congestive Heart Failure (SCD-HeFT). New England Journal of Medicine. 2005;352(3):225-237.
Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure (DANISH). New England Journal of Medicine. 2016;375(13):1221-1230.