Interprétation de l’ECG : caractéristiques d’un tracé électrocardiographique normal, incluant l’onde P, le complexe QRS, le segment ST et l’onde T
Interprétation de l’ECG : définitions, critères diagnostiques et caractéristiques morphologiques des ondes, ainsi que valeurs normales des intervalles, des durées et des rythmes
- Aperçu de l’électrocardiogramme normal
- L’onde P
- Intervalle PR et segment PR
- Le complexe QRS
- Implications et étiologies d’un complexe QRS élargi
- Amplitude du complexe QRS
- L’onde Q
- Le segment ST : Dépression et élévation du segment ST
- Modifications primaires et secondaires du segment ST-T
- Dépression du segment ST (Sous-décalage)
- Le sus-décalage du segment ST
- L’onde T
- Onde U
- Durée du QT et durée du QT corrigé (QTc)
- L’axe électrique du cœur (axe cardiaque)
Ce chapitre constitue sans doute l’un des volets les plus essentiels de cet ouvrage, posant les fondations de l’analyse électrocardiographique clinique. L’interprétation de l’électrocardiogramme (ECG) repose avant tout sur la capacité à évaluer la normalité des ondes et des intervalles, ainsi qu’à identifier les déviations pathologiques subtiles. L’accent est mis ici sur l’analyse morphologique des ondes (apparence), ainsi que sur la mesure précise de leurs durées et des intervalles correspondants. Une présentation détaillée et rigoureuse est proposée afin de fournir au lecteur une compréhension approfondie des tracés normaux, des variantes physiologiques moins fréquentes (telles que la repolarisation précoce ou les variantes positionnelles) et des anomalies pathologiques. Ce chapitre expose ainsi les bases physiologiques de chaque onde de l’ECG et les critères validés permettant de distinguer un tracé normal d’un tracé anormal. Bien que l’étude approfondie du rythme cardiaque et des arythmies complexes soit développée dans les chapitres suivants, les principes fondamentaux relatifs au rythme sinusal et aux mécanismes de base seront également abordés ici.
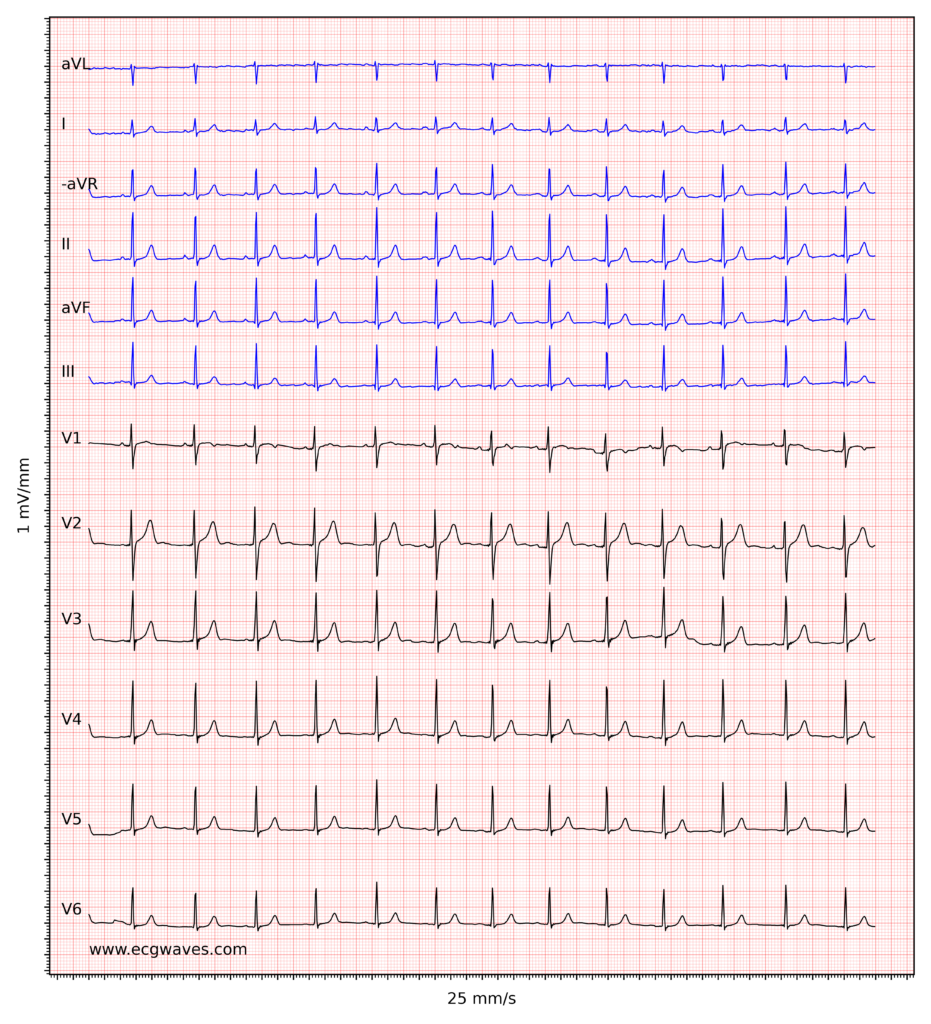
Aperçu de l’électrocardiogramme normal
L’interprétation de l’électrocardiogramme (ECG) repose sur l’analyse systématique de la morphologie des ondes et des intervalles enregistrés. Elle nécessite une approche structurée — classiquement : fréquence, rythme, axe, hypertrophie, ischémie/infarctus — permettant d’évaluer chaque composante de manière méthodique et reproductible. Avant d’aborder en détail chacune d’elles, un rappel des principales ondes et intervalles et de leur signification physiopathologique s’impose.

L’onde P, l’intervalle PR et le segment PR
L’interprétation de l’électrocardiogramme (ECG) débute classiquement par l’analyse de l’onde P, qui traduit la dépolarisation auriculaire. L’intervalle PR correspond à la durée séparant le début de l’onde P du début du complexe QRS et permet d’évaluer la normalité de la conduction de l’influx des oreillettes vers les ventricules (conduction auriculo-ventriculaire). Le segment PR, portion isoélectrique comprise entre la fin de l’onde P et le début du complexe QRS, reflète le ralentissement physiologique de la conduction au niveau du nœud auriculo-ventriculaire, essentiel pour le remplissage ventriculaire. Ce segment sert de ligne de base (ou ligne isoélectrique) de référence pour l’ECG, notamment pour évaluer les décalages du segment ST. Voir figure 1.
Le complexe QRS
Le complexe QRS correspond à la dépolarisation (activation) des ventricules. Il est désigné comme « complexe QRS » même lorsqu’il ne comporte pas les trois ondes typiques (Q, R, S). Comme le vecteur électrique généré par le ventricule gauche est nettement plus important que celui du ventricule droit du fait de sa masse musculaire supérieure, le complexe QRS reflète essentiellement la dépolarisation ventriculaire gauche. La durée du complexe QRS correspond à l’intervalle entre le début et la fin de celui-ci. Un complexe QRS de courte durée (fin) traduit une dépolarisation ventriculaire rapide et synchrone, suggérant un fonctionnement normal du système de conduction intraventriculaire (faisceau de His et réseau de Purkinje). À l’inverse, un complexe QRS élargi indique un ralentissement ou une désynchronisation de la dépolarisation ventriculaire, pouvant résulter d’un trouble de conduction intraventriculaire (bloc de branche) ou d’une origine ectopique de l’impulsion.
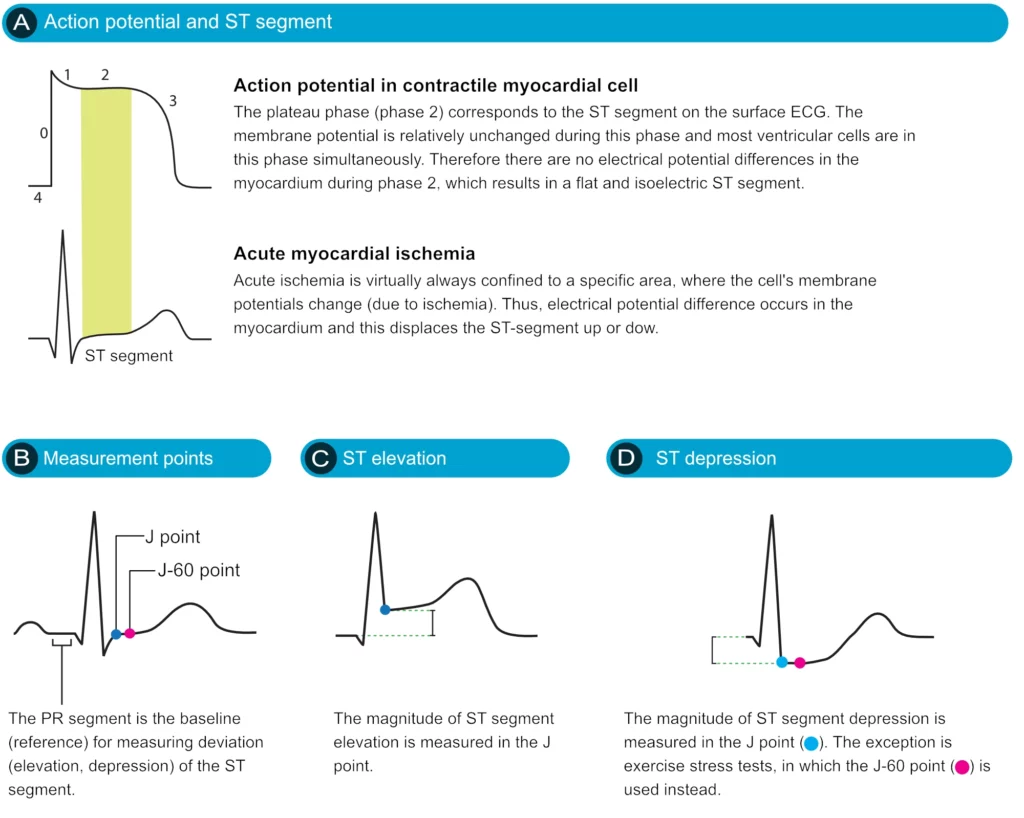
Le point J et le segment ST
Le segment ST correspond à la phase plateau (phase 2) du potentiel d’action ventriculaire, période durant laquelle les ventricules sont entièrement dépolarisés. Son analyse doit être réalisée avec attention, car il peut être modifié dans de nombreuses situations cliniques. L’étude du segment ST revêt une importance critique dans le contexte de l’ischémie myocardique aiguë, celle-ci pouvant entraîner une déviation du segment ST (sus-décalage ou sous-décalage) par rapport à la ligne isoélectrique. L’amplitude de la déviation se mesure en millimètres au niveau du point J — jonction entre la fin du complexe QRS et le début du segment ST — par rapport à la ligne de base définie par le segment PR (ou l’intervalle TP si le PR est instable).
L’onde T
L’onde T reflète la phase de repolarisation rapide des myocytes contractiles (phase 3 du potentiel d’action). Ses altérations peuvent survenir dans un large éventail de situations cliniques, allant des troubles électrolytiques (kaliémie) aux syndromes coronariens aigus. La transition entre le segment ST et l’onde T doit être progressive, sans rupture abrupte. L’onde T normale présente une asymétrie caractéristique, avec une pente ascendante plus lente que la pente descendante.
L’onde U
L’onde U est une petite déflexion positive de l’ECG, apparaissant immédiatement après l’onde T. Son amplitude correspond généralement à environ un quart de celle de l’onde T. Elle est le plus souvent visible dans les dérivations précordiales moyennes (V2 à V4). Sa présence est plus fréquente chez les patients présentant une bradycardie marquée. Bien que la physiopathologie exacte demeure débattue (repolarisation des fibres de Purkinje ou des cellules myocardiques de la couche moyenne M), son inversion ou son accentuation peut avoir une valeur pathologique.
Intervalle QT et intervalle QT corrigé (QTc)
La durée de l’intervalle QT correspond à la systole électrique ventriculaire (dépolarisation et repolarisation). Elle se mesure depuis le début du complexe QRS jusqu’à la fin de l’onde T. L’intervalle QT varie physiologiquement en fonction de la fréquence cardiaque : il s’allonge lorsque la fréquence diminue et se raccourcit lorsqu’elle augmente. Il est donc indispensable de corriger sa valeur en fonction de la fréquence cardiaque instantanée pour obtenir l’intervalle QT corrigé (QTc), le plus souvent via la formule de Bazett ou de Fridericia. Un allongement du QTc est un marqueur de risque d’arythmies ventriculaires polymorphes (torsades de pointes).
Nous présentons à présent une analyse détaillée de chacun des composants de l’électrocardiogramme (ECG).
L’onde P
L’interprétation de l’électrocardiogramme (ECG) débute généralement par l’analyse de l’onde P afin de déterminer l’origine du rythme (sinusal ou non). Celle-ci correspond à la dépolarisation auriculaire et se présente habituellement comme une petite onde positive, lisse et arrondie (« en dôme »). Sa faible amplitude (< 2,5 mm) s’explique par la masse musculaire relativement réduite des oreillettes par rapport aux ventricules. En rythme sinusal — c’est-à-dire dans des conditions physiologiques normales — le vecteur moyen de dépolarisation auriculaire est orienté vers le bas, l'avant et la gauche, ce qui se traduit par une onde P positive en dérivation II, I et aVF (figure 2, partie droite). La positivité en dérivation II est un critère fondamental du rythme sinusal.
Le vecteur de l’onde P présente une cinétique particulière dans le plan horizontal. L’activation débute dans l’oreillette droite (vecteur antérieur), puis se propage vers l’oreillette gauche (vecteur postérieur et gauche). En conséquence, la dérivation V1, située à droite du sternum, enregistre souvent une onde P biphasique : une composante initiale positive (activation OD) suivie d’une composante terminale négative (activation OG s’éloignant de V1). En revanche, la dérivation V5/V6 voit l’activation venir vers elle, inscrivant une onde P monophasique positive.
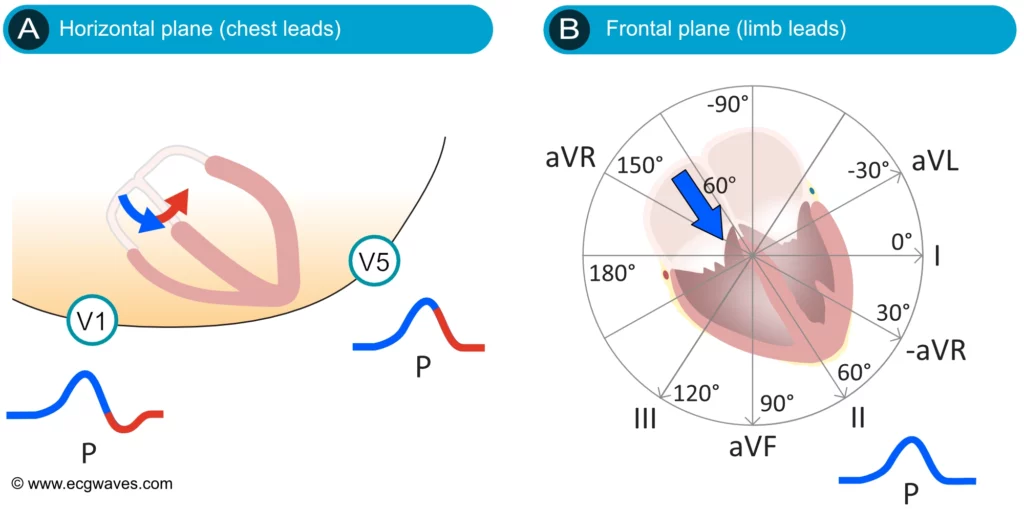
Il est important de noter que l’onde P, bien que globalement lisse, résulte de la superposition de l’activation de l’oreillette droite puis gauche. La première moitié de l’onde P reflète principalement la dépolarisation de l’oreillette droite, tandis que la seconde moitié correspond à celle de l’oreillette gauche. En cas de dilatation ou d’hypertrophie, cette dissociation peut devenir visible sous forme d’une onde P bifide ou crochetée.
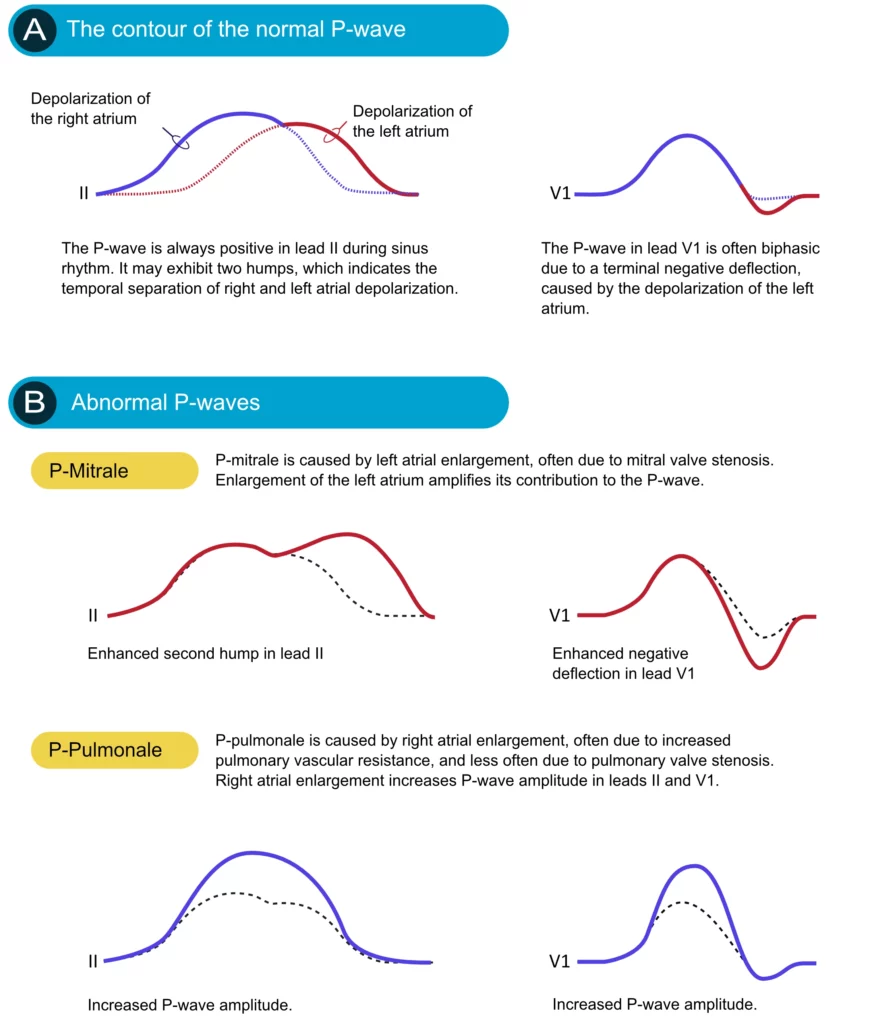
En cas de dilatation d’une oreillette, le plus souvent par un mécanisme de surcharge barométrique ou volumétrique, sa contribution à l’onde P est accentuée. L’hypertrophie auriculaire gauche ou droite induit des modifications caractéristiques de l’onde P (figure 3).
Hypertrophie auriculaire droite (HAD) : Elle résulte le plus souvent d’une pathologie pulmonaire (BPCO, hypertension artérielle pulmonaire) ou valvulaire (sténose pulmonaire, tricuspidienne). L’hypertrophie auriculaire droite augmente l’amplitude de la composante initiale de l’onde P. Il en résulte une onde P ample (> 2,5 mm) et pointue en dérivation II, III et aVF, sans allongement significatif de sa durée. Ce morphotype est classiquement appelé « P pulmonale ».
Hypertrophie auriculaire gauche (HAG) : En présence d’une surcharge de l’oreillette gauche (ex: hypertension artérielle, sténose mitrale, insuffisance mitrale), la composante terminale de l’onde P est retardée et amplifiée. Dans la dérivation II, l’onde P s’élargit (> 0,12 s) et devient bifide (aspect en « M »), avec un espacement entre les deux pics > 0,04 s. Dans V1, la composante négative terminale devient profonde et large (surface > 1 petit carreau, soit > 0,04 s x 1 mm). Ce tableau est appelé « P mitrale » (figure 3).
Une morphologie particulière à connaître est le bloc inter-auriculaire (ou syndrome de Bayés), caractérisé par une onde P très large (≥ 120 ms) et souvent biphasique (+/-) en dérivations inférieures, prédisposant à la fibrillation atriale.
Liste de vérification de l’onde P
- En rythme sinusal, l’onde P est constamment positive en dérivation II.
- L’onde P est presque toujours positive dans les dérivations aVL, aVF, I, V4, V5 et V6, et négative dans la dérivation aVR.
- L’onde P est fréquemment biphasique en dérivation V1, et parfois en V2. La composante négative présente une amplitude normale inférieure à 1 mm et une durée inférieure à 0,04 s.
- La durée de l’onde P doit être inférieure à 0,12 seconde (120 ms).
- L’amplitude de l’onde P doit être inférieure à 2,5 mm dans les dérivations périphériques.
- La P pulmonale (HAD) : onde P > 2,5 mm en II, III, aVF.
- La P mitrale (HAG) : onde P > 0,12 s, bifide en II ou biphasique en V1 avec composante terminale négative marquée.
Intervalle PR et segment PR
L’intervalle PR se mesure du début de l’onde P au début du complexe QRS (figure 1). Il inclut la dépolarisation auriculaire et le délai de conduction dans le nœud AV et le système His-Purkinje. Chez l’adulte, sa valeur normale se situe entre 0,12 s et 0,20 s (jusqu’à 0,22 s chez le sujet âgé). Le segment PR, quant à lui, est la ligne isoélectrique entre la fin de l’onde P et le début du QRS.

Allongement du PR : Un intervalle PR > 0,20-0,22 s définit le bloc auriculo-ventriculaire (BAV) du 1er degré. Il traduit un ralentissement de la conduction, le plus souvent nodal. Les causes incluent le tonus vagal élevé (athlètes), les médicaments (bêta-bloquants, inhibiteurs calciques bradycardisants, digoxine), les désordres électrolytiques ou les dégénérescences du tissu conductif.
Raccourcissement du PR : Un intervalle PR < 0,12 s peut être observé dans trois situations principales :
1. Rythme jonctionnel ou auriculaire bas (l’influx naît près du ventricule).
2. Syndrome de pré-excitation (Wolff-Parkinson-White), où une voie accessoire court-circuite le nœud AV (voir figure 4C).
3. Syndrome de Lown-Ganong-Levine (conduction nodale accélérée, entité historique controversée).
Anomalie du segment PR : Le sous-décalage du segment PR est un signe subtil mais très spécifique de péricardite aiguë (signe de Spodick). Il traduit une inflammation de l’épicarde auriculaire. À l’inverse, un sus-décalage du segment PR en dérivation aVR (en miroir) conforte ce diagnostic.
Liste de vérification de l’intervalle PR
- Intervalle PR normal : 0,12 à 0,20 seconde.
- PR > 0,20 s : Bloc AV du 1er degré.
- PR < 0,12 s + onde Delta : Syndrome de Wolff-Parkinson-White.
- Sous-décalage du segment PR : Évocateur de péricardite aiguë.
Le complexe QRS
Le complexe QRS représente la somme des vecteurs de dépolarisation de la masse ventriculaire. Sa morphologie varie selon la dérivation d’enregistrement.
Dénomination des ondes du complexe QRS :
La nomenclature standard est la suivante (voir figure 5) :
- Onde Q (ou q) : Toute première déflexion négative avant une onde positive.
- Onde R (ou r) : Toute déflexion positive. S’il y en a plusieurs, la seconde est notée R’.
- Onde S (ou s) : Toute déflexion négative suivant une onde positive.
- QS : Un complexe entièrement négatif, sans onde R visible.
L’utilisation de majuscules (Q, R, S) indique une onde de grande amplitude (> 5 mm), tandis que les minuscules (q, r, s) désignent des ondes de faible amplitude.

Orientation nette du complexe QRS
Le complexe QRS peut être qualifié de positif net ou de négatif net. Cette notion est cruciale pour déterminer l’axe électrique du cœur. Il est positif si la surface au-dessus de la ligne isoélectrique est supérieure à la surface en dessous.

Vecteurs électriques à l’origine du complexe QRS
La dépolarisation ventriculaire séquentielle génère des vecteurs distincts expliquant la morphologie QRS (Figure 7) :

- Vecteur 1 (Septal) : Dépolarisation du septum de la gauche vers la droite. Produit une petite onde r en V1 et une petite onde q (« q septale ») en V5/V6.
- Vecteur 2 (Pariétal) : Activation majeure des parois libres ventriculaires. Le vecteur massif du ventricule gauche prédomine, orienté vers la gauche et l’arrière. Cela génère une grande onde R en V5/V6 et une onde S profonde en V1.
- Vecteur 3 (Basal) : Activation tardive des bases des ventricules (postéro-supérieure). Peut générer une petite onde s terminale en V5/V6.
Implications et étiologies d’un complexe QRS élargi
La durée normale du QRS est de 0,08 à 0,10 s. Un QRS entre 0,10 et 0,12 s est dit modérément élargi (bloc incomplet). Un QRS ≥ 0,12 s est pathologique. Les causes principales d’élargissement sont :
- Blocs de branche (Droit ou Gauche) : Interruption de la conduction dans une branche, obligeant l’influx à passer par le myocarde (conduction lente) pour activer le ventricule opposé.
- Hyperkaliémie : Ralentissement global de la conduction intra-myocardique.
- Médicaments (effet stabilisant de membrane) : Antiarythmiques de classe I (flécaïnide), antidépresseurs tricycliques.
- Rythmes d’origine ventriculaire : Extrasystoles ventriculaires (ESV), tachycardies ventriculaires (TV), rythme idioventriculaire.
- Stimulation cardiaque (Pacemaker) : La stimulation du ventricule droit crée un aspect de bloc de branche gauche.
- Pré-excitation (WPW) : L’onde delta élargit la base du QRS.
- Hypothermie sévère et Acidose sévère.

Amplitude du complexe QRS
Les amplitudes du QRS sont cruciales pour le diagnostic d’hypertrophie. Des QRS microvoltés (faible amplitude) peuvent se voir en cas d’épanchement péricardique, de BPCO (effet isolant de l’air), d’obésité, d’hypothyroïdie ou d’amylose cardiaque.
Critères d’amplitude (Hypertrophie)
L’hypertrophie ventriculaire gauche (HVG) augmente l’amplitude des ondes R en précordiales gauches (V5, V6) et la profondeur des ondes S en précordiales droites (V1, V2). Les indices les plus utilisés sont :
- Indice de Sokolow-Lyon : S en V1 + R en V5 (ou V6) > 35 mm (3,5 mV).
- Critères de Cornell : R en aVL + S en V3 > 28 mm (hommes) ou > 20 mm (femmes).
- R en aVL > 11 mm : signe isolé d’HVG très spécifique.
L’hypertrophie ventriculaire droite (HVD) se manifeste par une grande onde R en V1 (R > S) et une déviation axiale droite.
Temps de culmination de l’onde R (Déflexion intrinsécoïde)
Ce temps, mesuré du début du QRS au sommet de l’onde R, reflète le temps d’activation de l’endocarde à l’épicarde. Un allongement traduit un épaississement pariétal (hypertrophie) ou un retard de conduction local.

Progression de l’onde R et Zone de Transition
Normalement, l’onde r croît de V1 à V5. La « zone de transition » est la dérivation où l’onde R et l’onde S sont d’amplitudes égales (rapport R/S = 1), se situant physiologiquement en V3 ou V4.
– Une transition précoce (V1-V2) suggère une rotation anti-horaire du cœur ou une HVD.
– Une transition tardive (V5-V6) suggère une rotation horaire, une dilatation du VD ou un infarctus antérieur ancien (amputation de R).

Onde R dominante en V1/V2
Une grande onde R en V1 est toujours anormale chez l’adulte. Les étiologies principales sont :
1. Hypertrophie ventriculaire droite.
2. Infarctus postérieur (image en miroir : grande R en V1 = onde Q en postérieur).
3. Syndrome de WPW (voie accessoire gauche).
4. Bloc de branche droit.
L’onde Q
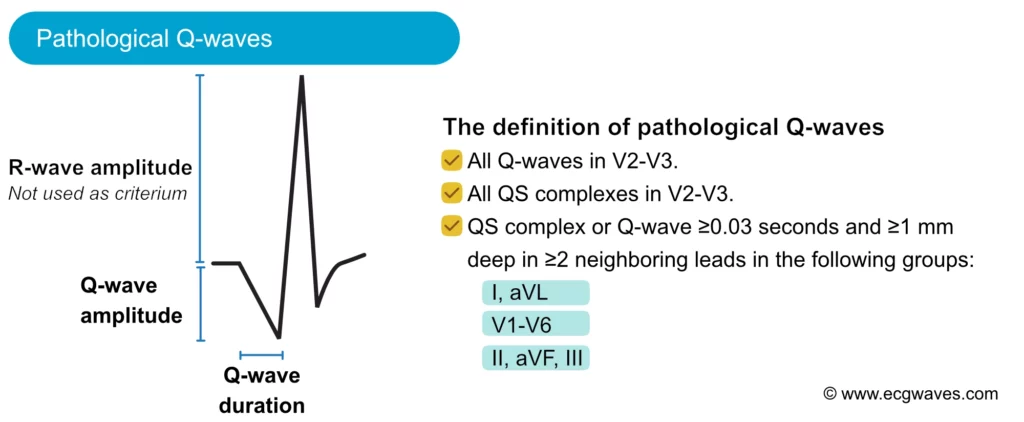
L’onde Q peut être physiologique (fine et peu profonde, septale) ou pathologique (séquelle de nécrose). Une onde Q est dite pathologique si :
– Sa durée est ≥ 0,03 s (30 ms) ou 0,04 s selon les critères.
– Son amplitude dépasse 25% de l’onde R suivante.
– Elle est présente dans des territoires contigus (ex: II, III, aVF pour l’inférieur).
Variantes normales et « Pseudo-infarctus »
Il est crucial de ne pas sur-diagnostiquer un infarctus :
– Onde Q positionnelle en DIII : Disparaît souvent à l’inspiration profonde. Isolée (absente en aVF), elle n’est pas pathologique.
– QS en V1 : Normal. Mais un QS en V1 et V2 est suspect.
– Pseudo-ondes Q du WPW : L’onde delta négative dans certaines dérivations peut simuler une nécrose (pseudo-infarctus inférieur ou antérieur).

Le segment ST : Dépression et élévation du segment ST
Le segment ST est le marqueur clé de l’ischémie myocardique aiguë. Normalement isoélectrique, il peut présenter des décalages significatifs.
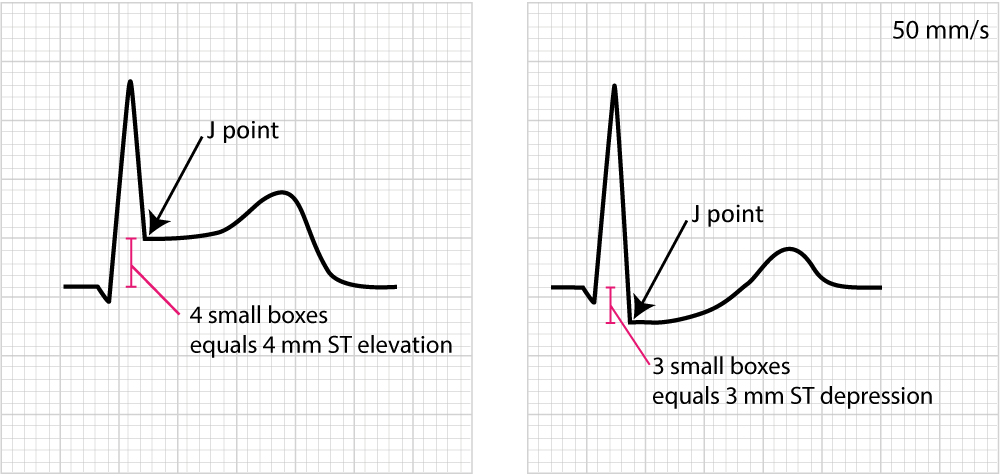
Point de mesure : Le décalage se mesure au Point J (Jonction QRS-ST). Cependant, en cas de tachycardie ou de pente ascendante rapide, on mesure souvent à J+60ms ou J+80ms. La référence est le segment PR (ou segment TP).
Modifications primaires et secondaires du segment ST-T
Une distinction fondamentale doit être faite :
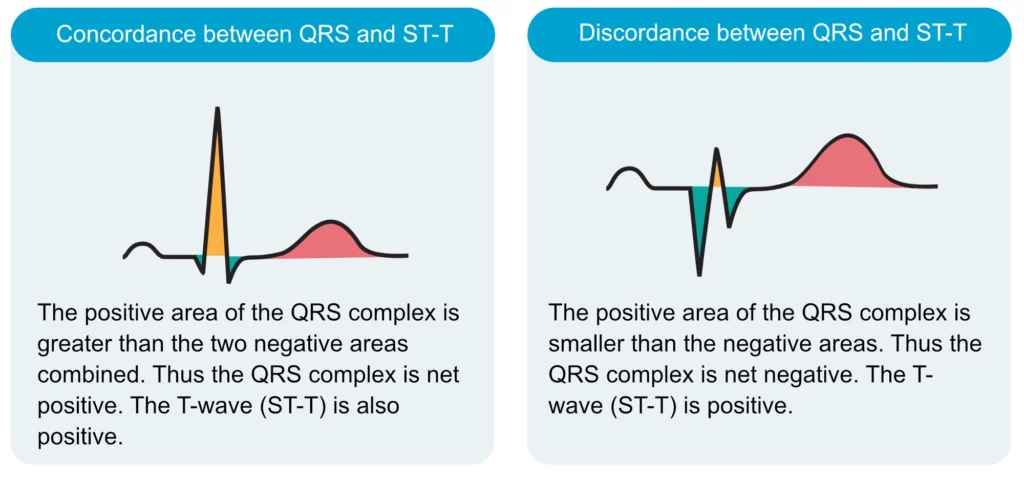
– Modifications primaires : Liées à une anomalie directe de la repolarisation (ischémie, péricardite, troubles ioniques) alors que le QRS est fin.
– Modifications secondaires : Conséquence obligatoire d’une dépolarisation anormale (Bloc de branche, HVG, WPW). Le ST part dans le sens opposé au QRS (« discordance appropriée »). Un sus-décalage concordant (dans le même sens que le QRS) dans un bloc de branche gauche est par contre très suspect d’infarctus (Critères de Sgarbossa).
Dépression du segment ST (Sous-décalage)
Un sous-décalage ≥ 0,5 mm (0,05 mV) est pathologique. La morphologie est cruciale (Figure 15) :
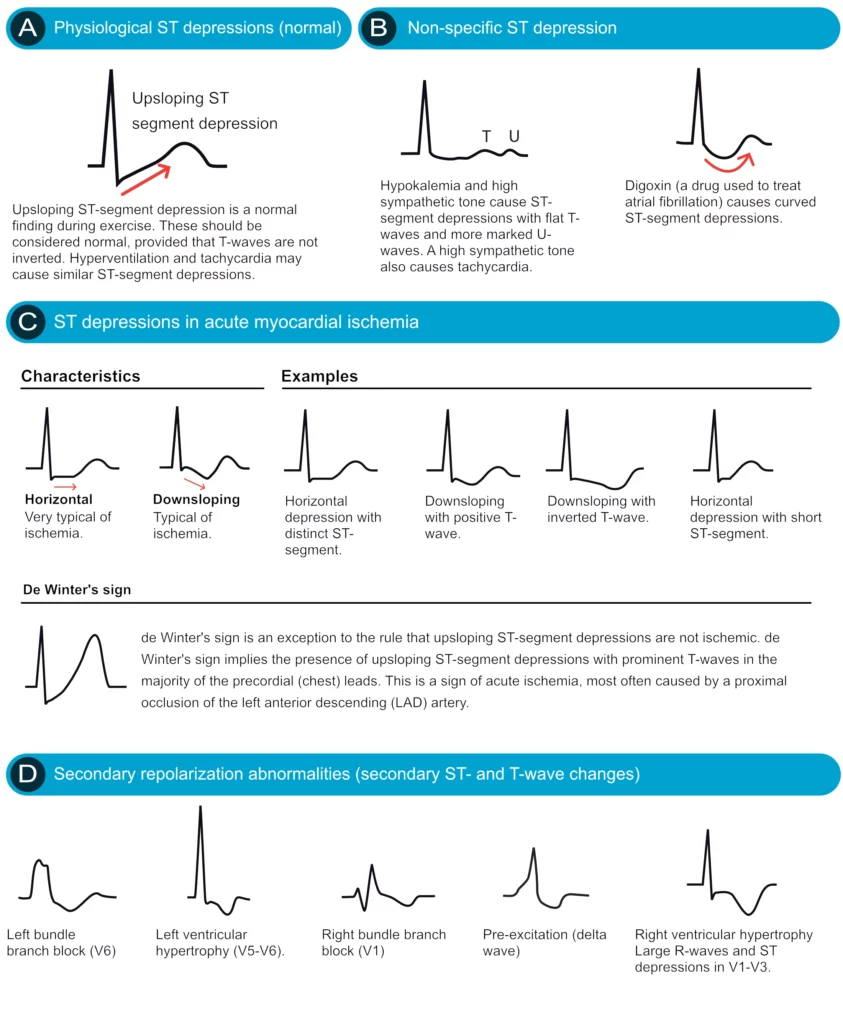
- Ischémie sous-endocardique : Sous-décalage horizontal ou descendant. C’est le signe typique de l’angine de poitrine ou du NSTEMI.
- Cupule digitalique : Sous-décalage concave, « en moustaches de Dali », typique de l’imprégnation en Digoxine.
- Images en miroir : Un sous-décalage en précordiales droites (V1-V3) peut être l’image en miroir d’un sus-décalage (infarctus) postérieur.
Une mention spéciale pour le syndrome de Wellens et le signe de de Winter (sous-décalage ascendant + grande onde T) qui sont des équivalents d’obstruction aiguë de l’IVA proximale.
Le sus-décalage du segment ST
Le sus-décalage (élévation) du segment ST est l’anomalie la plus alarmante car elle évoque l’infarctus transmural (STEMI). Cependant, il faut savoir différencier l’étiologie ischémique des causes bénignes ou inflammatoires (Figure 16).

- STEMI (Infarctus) : Sus-décalage convexe vers le haut (« en dôme »), localisé à un territoire artériel, souvent avec des images en miroir (sous-décalage) dans les dérivations opposées.
- Péricardite aiguë : Sus-décalage diffus, concave vers le haut, sans images en miroir (sauf en aVR), associé à un sous-décalage du PR.
- Repolarisation précoce : Sus-décalage concave, avec un empâtement ou une encoche (« notch ») distincte au point J, stable dans le temps, fréquent chez le sujet jeune et l’athlète.
L’onde T
L’onde T normale est asymétrique. Elle est positive partout sauf en aVR et parfois en V1. Elle doit être « concordante » avec le QRS (positive si QRS positif).
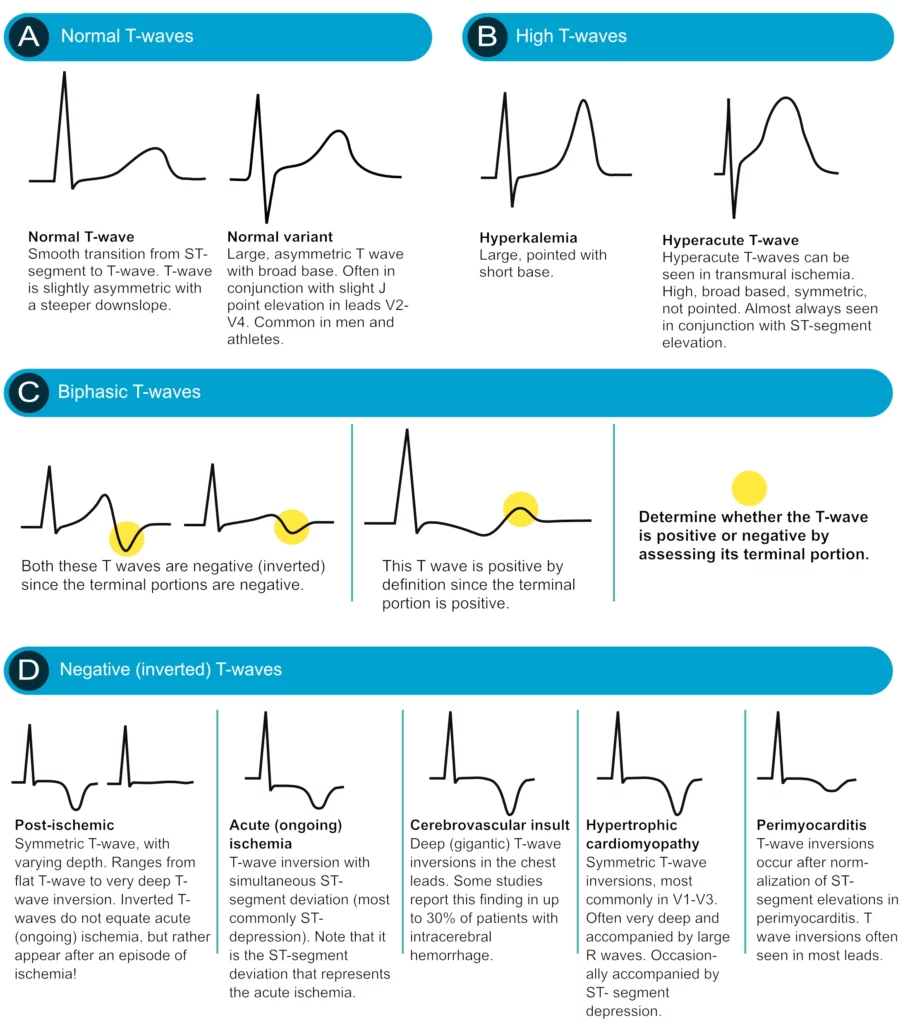
Ondes T amples et pointues
Deux causes majeures à distinguer :
1. Hyperkaliémie : Onde T pointue, à base étroite, « en tente », symétrique, diffuse. Urgence vitale.
2. Ischémie hyperaiguë : Onde T ample, large à la base, localisée à un territoire. Signe très précoce d’occlusion coronaire (avant le sus-décalage ST).
Inversion de l’onde T
Une onde T négative profonde et symétrique est typique de l’ischémie (reperfusion ou ischémie évolutive). Cependant, des ondes T négatives géantes (> 10 mm) et larges peuvent se voir lors d’hémorragies intracrâniennes (Ondes T cérébrales) ou de cardiomyopathie apicale.

Onde U
L’inversion de l’onde U (négative) est toujours pathologique et très spécifique d’ischémie myocardique ou de surcharge ventriculaire gauche.
Durée du QT et durée du QT corrigé (QTc)
L’allongement du QT est un facteur de risque majeur de Torsades de Pointes et de mort subite. Il doit être corrigé pour la fréquence cardiaque.
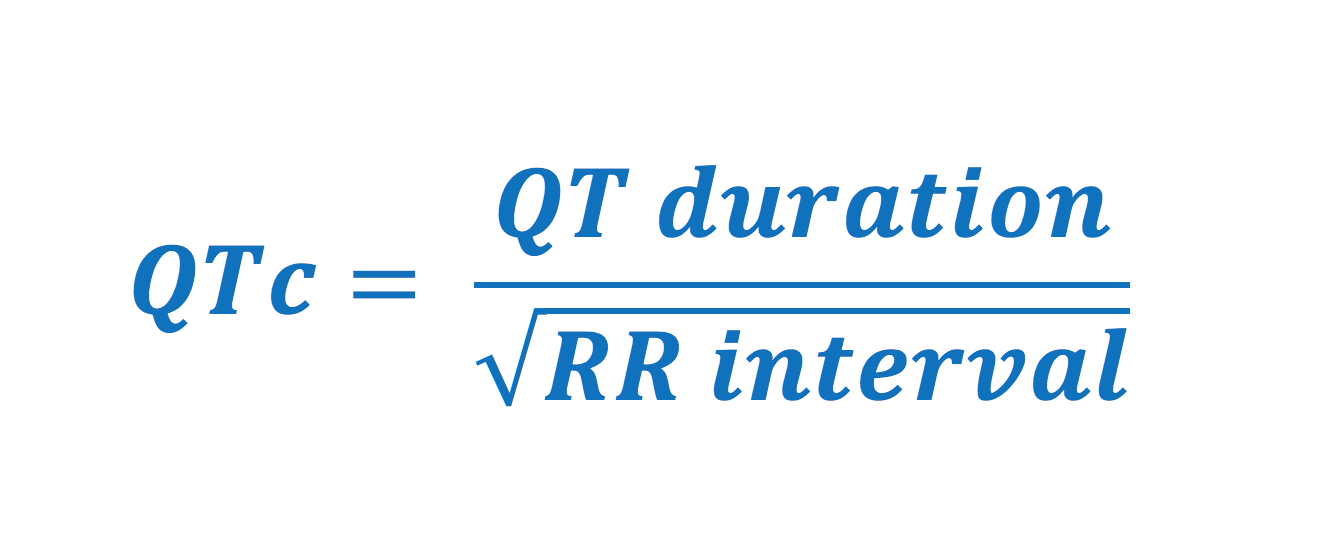
Valeurs normales pour l’intervalle QTc
- Hommes : <0,450 secondes (450 ms)
- Femmes : <0,460 secondes (460 ms)
Limites de Bazett : Cette formule surestime le QTc en cas de tachycardie (> 100 bpm) et le sous-estime en cas de bradycardie (< 60 bpm). Dans ces cas, les formules de Fridericia ou de Framingham sont préférables.
L’axe électrique du cœur (axe cardiaque)
L’axe électrique correspond à la direction moyenne de l’activation ventriculaire dans le plan frontal. Il se détermine grâce aux dérivations des membres (I, II, III, aVR, aVL, aVF).
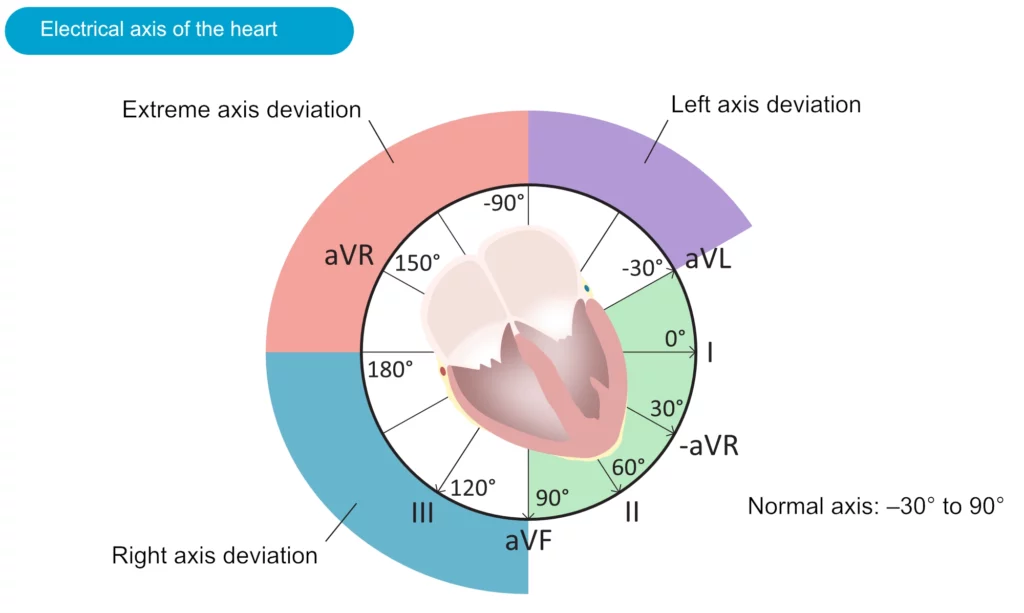
Méthode rapide de détermination (Règle des quadrants)
- Axe normal (-30° à +90°) : QRS positif en I et positif en II.
- Déviation axiale gauche (-30° à -90°) : QRS positif en I mais négatif en II. (Souvent lié à un hémibloc antérieur gauche ou HVG).
- Déviation axiale droite (+90° à +180°) : QRS négatif en I mais positif en aVF. (HVD, hémibloc postérieur gauche, embolie pulmonaire).
- Axe hyper-droit (« No man’s land », -90° à -180°) : QRS négatif en I et négatif en aVF. Rare (TV, erreur d’électrodes).
Pour plus de précision, on cherche la dérivation isoélectrique (QRS biphasique équitable) : l’axe électrique est perpendiculaire à cette dérivation.