Physiologie électrique du cœur : mécanismes cellulaires et vecteurs de l’activité électrophysiologique
Électrophysiologie cardiaque : potentiels membranaires, potentiels d’action, automaticité et vecteurs électriques
Le fonctionnement cardiaque repose sur une activité électrique parfaitement synchronisée, prérequis indispensable à l’efficacité mécanique de la pompe cardiaque. Le potentiel d’action cardiaque se caractérise par une phase de dépolarisation (activation) suivie d’une phase de repolarisation (récupération). Il est présent dans toutes les cellules myocardiques, mais sa morphologie et ses propriétés électrophysiologiques varient considérablement selon le type cellulaire (cellules nodales versus cellules contractiles). Au cours de la dépolarisation et de la repolarisation, des ions sodium (Na⁺), potassium (K⁺) et calcium (Ca²⁺) traversent la membrane cellulaire dans un sens ou dans l’autre via des canaux ioniques spécifiques. Étant électriquement chargés, leurs déplacements génèrent un courant électrique transmembranaire. La propagation du potentiel d’action correspond à la propagation de ce courant de proche en proche, créant un front d’onde d’activation.
L’ensemble des tissus et des fluides entourant le cœur contient une forte concentration d’ions dissous, leur conférant des propriétés de conducteur volumique. Ainsi, les courants électriques générés par l’activité myocardique ne restent pas confinés au cœur mais se propagent à travers l’organisme jusqu’à la surface cutanée, où ils génèrent des différences de potentiel détectables à l’aide d’électrodes. L’électrocardiographe enregistre et analyse ces signaux électriques, puis les restitue sous la forme d’un électrocardiogramme (ECG). Comme mentionné précédemment, les potentiels électriques issus du système de conduction cardiaque spécialisé (nœud sinusal, faisceau de His) sont de trop faible amplitude pour être directement détectés par des électrodes de surface ; l’ECG standard reflète donc principalement l’activité électrique de la masse musculaire des myocytes auriculaires et ventriculaires.
L’automaticité des cellules pacemaker
L’automaticité des cellules du nœud sinusal est le fondement du rythme cardiaque normal. Elle résulte d’une instabilité du potentiel de membrane durant la phase de repos, due à l’entrée progressive de sodium (Na+) dans la cellule dès la fin de la repolarisation précédente (figure 1). Ce courant entrant spécifique, souvent désigné sous le nom de courant « funny » (If), entraîne une dépolarisation graduelle de la membrane appelée dépolarisation diastolique spontanée. Lorsque le potentiel membranaire atteint le seuil d’environ –40 mV, un potentiel d’action est déclenché. À ce seuil, les canaux calciques voltage‑dépendants (Ca2+) de type L s’ouvrent, permettant un afflux massif de calcium responsable de la phase ascendante (rapide) de la dépolarisation dans ces cellules nodales. La phase de repolarisation débute ensuite par l’inactivation des canaux calciques et l’ouverture des canaux potassiques (K+) voltage‑dépendants, favorisant la sortie de potassium et le retour au potentiel diastolique maximal. Ce cycle se répète de manière rythmique (figure 1).
Il convient de noter que la pente de cette dépolarisation spontanée (phase 4) est modulée par le système nerveux autonome : la stimulation sympathique augmente la pente (accélérant la fréquence cardiaque), tandis que la stimulation parasympathique la diminue. C’est ce mécanisme qui régit la chronotropie cardiaque.

La dépolarisation se propage du nœud sinusal vers le myocarde auriculaire puis ventriculaire. La conduction du potentiel d’action est rendue possible par l’interconnexion électrique de toutes les cellules cardiaques via des jonctions lacunaires (gap junctions) (figure 1). Ces jonctions, constituées de canaux protéiques (connexines) reliant les membranes des cellules adjacentes, offrent une faible résistance électrique, permettant le passage direct d’ions et assurant ainsi la transmission du potentiel d’action de cellule en cellule comme un syncytium fonctionnel.
La densité et le type de connexines déterminent la vitesse de conduction. La densité particulièrement élevée de jonctions lacunaires dans les fibres du réseau de Purkinje explique la vitesse très élevée de conduction (jusqu’à 4 m/s) dans ce système, assurant une activation ventriculaire rapide et synchrone. À l’inverse, les cellules du nœud auriculo‑ventriculaire présentent une faible densité de jonctions lacunaires et une géométrie cellulaire complexe, ce qui entraîne un ralentissement physiologique majeur de la conduction. Ce délai est crucial pour permettre le remplissage ventriculaire avant la systole. De même, la transmission du potentiel d’action entre les cardiomyocytes contractiles est plus lente (environ 0,5 à 1 m/s), en raison de la moindre abondance de jonctions lacunaires comparée au réseau de Purkinje.
Le potentiel d’action des cellules myocardiques contractiles
Les cellules contractiles (myocytes auriculaires et ventriculaires), à la différence des cellules du nœud sinusal, présentent un véritable potentiel de repos stable (phase 4) d’environ –90 mV, maintenu principalement par les canaux potassiques à rectification entrante (IK1). Elles ne possèdent pas d’automaticité physiologique et nécessitent une stimulation externe (d’une cellule voisine) pour déclencher un potentiel d’action. Lors de cette stimulation, si le potentiel atteint le seuil d’excitabilité (environ -70 mV), l’ouverture explosive des canaux sodiques rapides (Na+) entraîne un afflux massif d’ions sodium, provoquant la dépolarisation cellulaire quasi instantanée. La durée du potentiel d’action est d’environ 0,20 seconde dans le myocarde auriculaire et de 0,30 seconde dans le myocarde ventriculaire (figure 1).
Les différentes phases sont également représentées dans la figure 1 ci-dessus et se décomposent comme suit :
- Phase 4 (phase de repos) : Au cours de cette phase, le potentiel de membrane est stable. L’équilibre est maintenu par la sortie de potassium via les canaux IK1 et l’activité constante de la pompe Na+/K+ ATPase qui restaure les gradients ioniques.
- Phase 0 (dépolarisation rapide) : Sous l’effet d’un stimulus, une dépolarisation brutale survient par un influx massif de sodium (Na+) à travers les canaux sodiques voltage‑dépendants rapides (INa). Le potentiel membranaire s’inverse transitoirement, atteignant environ +20 à +30 mV. C’est cette phase qui correspond au complexe QRS sur l’ECG.
- Phase 1 (repolarisation précoce) : Elle correspond à une brève repolarisation due à l’inactivation rapide des canaux sodiques et à l’ouverture transitoire de canaux potassiques spécifiques ($I_{to}$), entraînant un bref efflux de K+.
- Phase 2 (phase de plateau) : C’est la caractéristique distinctive du cardiomyocyte. Presque simultanément à la fin de la phase 1, des canaux calciques de type L (Long-lasting) s’ouvrent. L’influx de calcium (courant entrant) est alors contrebalancé par un efflux de potassium (courant sortant). Cet équilibre maintient le potentiel de membrane à un niveau quasi stable (le plateau). Cette entrée de calcium est fondamentale car elle déclenche la contraction musculaire (couplage excitation-contraction).
- Phase 3 (repolarisation terminale) : Les canaux calciques de type L se ferment progressivement, tandis que les canaux potassiques voltage‑dépendants (rectifieurs retardés, $I_Kr$ et $I_Ks$) s’activent pleinement. L’efflux massif de K+ qui en résulte devient prédominant et restaure rapidement le potentiel de membrane vers sa valeur de repos négative. Cette phase correspond à l’onde T sur l’ECG.
Enfin, il est crucial de mentionner le rôle de la pompe Na+/K+ ATPase. Bien qu’elle soit active en permanence, son rôle est vital après chaque potentiel d’action pour expulser l’excès de sodium entré pendant la dépolarisation et réintroduire le potassium sorti pendant la repolarisation, préservant ainsi l’homéostasie ionique cellulaire à long terme.
Couplage Excitation-Contraction
L’objectif ultime de l’activité électrique décrite ci-dessus est de générer une force mécanique. Le lien entre le potentiel d’action et la contraction des sarcomères est appelé couplage excitation-contraction. Le rôle central est joué par l’ion calcium (Ca²⁺). Durant la phase de plateau (Phase 2), l’entrée de calcium extracellulaire via les canaux de type L ne suffit pas à elle seule à provoquer la contraction, mais elle agit comme une « gâchette ». Ce calcium entrant active les récepteurs à la ryanodine (RyR) situés sur le réticulum sarcoplasmique (le réservoir de calcium interne de la cellule), provoquant une libération massive de calcium stocké vers le cytoplasme. Ce phénomène est connu sous le nom de libération de calcium induite par le calcium (CICR). L’augmentation brutale de la concentration calcique intracellulaire permet alors l’interaction entre les filaments d’actine et de myosine, aboutissant à la contraction cardiaque (systole).
Périodes réfractaires absolue et relative au cours du potentiel d’action
La protection contre la tétanisation du muscle cardiaque est assurée par la longueur de ses périodes réfractaires. Pendant la majeure partie du potentiel d’action (phases 0, 1, 2 et début de phase 3), la cellule myocardique se trouve en période réfractaire absolue (ou effective), ce qui signifie que les canaux sodiques sont inactivés et qu’aucun stimulus, quelle qu’en soit l’intensité, ne peut déclencher un nouveau potentiel d’action propagé. Cette phase est suivie d’une période réfractaire relative, durant la fin de la phase 3, où une partie des canaux sodiques a récupéré. Durant cet intervalle, un stimulus d’intensité supra-liminaire peut induire un nouveau potentiel d’action, bien que celui-ci soit généralement de moindre amplitude et de conduction plus lente. Les périodes réfractaires absolue et relative sont illustrées respectivement dans la figure 1 (ci-dessus) et la figure 2 (ci-dessous).

Comme l’illustre la figure 2, la période réfractaire relative coïncide électrocardiographiquement avec la seconde moitié et l’apex de l’onde T. Cette phase est classiquement décrite comme une période vulnérable du cycle cardiaque. En effet, la dispersion de la repolarisation est maximale à ce moment : certaines fibres sont complètement repolarisées et excitables, tandis que d’autres sont encore réfractaires. Une stimulation électrique prématurée appliquée à cet instant précis peut créer des circuits de réentrée fonctionnelle et déclencher des arythmies ventriculaires malignes, telles que la fibrillation ventriculaire.
Ce phénomène, bien que rare sur un cœur sain, est une préoccupation majeure en pathologie. Le stimulus déclencheur est le plus souvent une extrasystole ventriculaire (battement prématuré). Lorsqu’une telle dépolarisation ventriculaire survient pendant l’onde T du complexe précédent, on parle de phénomène « R‑sur‑T ». Il convient de souligner que le risque de dégénérescence en fibrillation ventriculaire est particulièrement élevé en présence d’une instabilité électrique, notamment lors d’un infarctus du myocarde aigu (ischémie), en cas d’hypokaliémie sévère, ou chez les patients porteurs d’un syndrome du QT long (congénital ou acquis). La figure 3 illustre deux exemples de phénomène R‑sur‑T.

Que montre l’ECG ?
La figure 4 illustre les morphologies classiques des ondes de l’électrocardiogramme (ECG), qui représentent la somme vectorielle de l’activité électrique de millions de cellules cardiaques. La première déflexion, appelée onde P, correspond à l’activation (dépolarisation) des oreillettes. Sa durée et son amplitude reflètent la masse et la vitesse de conduction auriculaire. La repolarisation auriculaire (l’onde Ta) n’est généralement pas visible, car elle est de faible voltage et survient simultanément à la dépolarisation ventriculaire massive, se trouvant ainsi noyée dans le complexe QRS.
La dépolarisation ventriculaire se manifeste par le complexe QRS, constitué des ondes Q (première onde négative), R (toute onde positive) et S (onde négative suivant une onde positive). Les variations de direction et d’amplitude de ces ondes selon les dérivations reflètent la séquence spatio-temporelle de l’activation ventriculaire. Enfin, l’onde T traduit la repolarisation des ventricules, processus actif consommant de l’énergie pour restaurer les gradients ioniques.

Intervalles et Segments : Signification Clinique
Observer la ligne isoélectrique située entre l’onde P et le complexe QRS (figure 4). Ce segment, inclus dans l’intervalle PR, traduit le temps nécessaire à l’influx pour traverser les oreillettes, le nœud auriculo‑ventriculaire (NAV) et le système His-Purkinje. Un allongement de l’intervalle PR (> 200 ms) signe un bloc auriculo-ventriculaire du premier degré.
Le segment ST, compris entre la fin du complexe QRS (point J) et le début de l’onde T, correspond à la phase de plateau du potentiel d’action ventriculaire, où l’ensemble du myocarde est dépolarisé. Normalement isoélectrique, son décalage (sus- ou sous-décalage) est le signe cardinal de l’ischémie myocardique aiguë.
Enfin, l’intervalle QT représente la durée totale de la systole électrique ventriculaire (dépolarisation + repolarisation). Sa durée doit être corrigée en fonction de la fréquence cardiaque (QTc). Un allongement pathologique du QT est un marqueur de risque d’arythmies ventriculaires sévères (torsades de pointes).
Il est essentiel de comprendre la genèse de ces ondes, ce qui implique la maîtrise des vecteurs électriques présents au cours du cycle cardiaque. La théorie vectorielle étant relativement complexe, la discussion qui suit se limitera aux principaux vecteurs électriques et à leur influence sur la morphologie de la courbe électrocardiographique.
Vecteurs électriques
Un vecteur est une grandeur physique caractérisée par une magnitude (taille), une direction et un sens dans l’espace. Le déplacement des particules électriquement chargées, qui survient lors de la propagation du potentiel d’action cardiaque, génère un dipôle électrique. La dépolarisation se propage à travers le myocarde de manière analogue à un front d’onde se déplaçant à la surface de l’eau. À chaque instant, de multiples fronts d’onde dépolarisants se diffusent simultanément dans les trois dimensions du myocarde (figure 5, partie gauche). La somme vectorielle instantanée de l’ensemble de ces micro-vecteurs correspond au vecteur électrique moyen (Mean Electrical Vector) à un instant donné (figure 5, partie droite). Ce vecteur électrique reflète ainsi la direction prédominante du courant cardiaque. Les tracés électrocardiographiques ne sont finalement que l’enregistrement de la succession de ces vecteurs électriques au cours du temps.

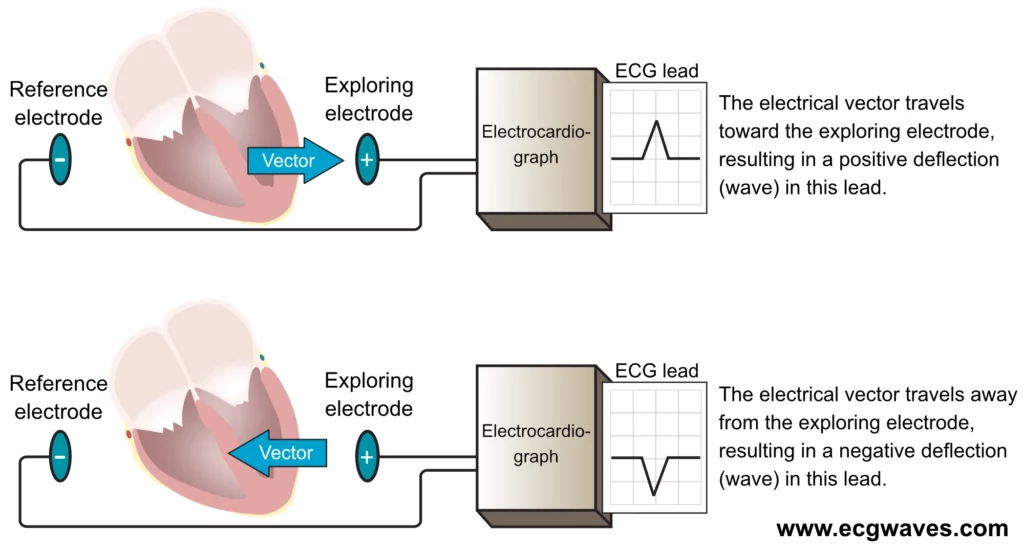
Pour comprendre comment un vecteur électrique se traduit par une onde sur le tracé électrocardiographique (ECG), il est indispensable de connaître le principe de construction des dérivations. Les dérivations ECG seront abordées en détail dans le chapitre suivant ; nous nous limiterons ici aux aspects en lien direct avec les vecteurs électriques. L’électrocardiographe utilise le principe du galvanomètre différentiel pour enregistrer une dérivation (figure 6), en comparant les potentiels électriques captés entre deux points. L’un est défini comme pôle positif (ou électrode exploratrice) et l’autre comme pôle négatif (ou référence). L’appareil est conçu de telle sorte qu’un vecteur de dépolarisation orienté vers l’électrode exploratrice génère une déflexion positive (au-dessus de la ligne isoélectrique) sur le tracé ECG, tandis qu’un vecteur s’en éloignant produit une déflexion négative (figure 6). Si le vecteur est perpendiculaire à l’axe de la dérivation, la déflexion enregistrée est minime ou biphasique.
Il est traditionnellement enseigné que l’électrode exploratrice est celle qui « observe » l’activité cardiaque, notion qui facilite l’interprétation de l’électrocardiogramme. Le fondement physiologique de ce concept est détaillé ci‑après.
Maintenant que la relation entre les vecteurs électriques cardiaques et les ondes de l’ECG a été clarifiée, il convient d’examiner les principaux vecteurs du cœur et la manière dont ils génèrent la morphologie classique de la courbe électrocardiographique. Les dérivations précordiales V1 et V5 ont été choisies ici à des fins pédagogiques, car elles enregistrent principalement l’activité électrique se propageant dans le plan horizontal (coupe transversale du thorax).
Cette orientation est liée à la position respective de l’électrode exploratrice et de l’électrode de référence. L’électrode exploratrice est placée directement sur la paroi thoracique (V1 au 4ème espace intercostal droit, V5 au 5ème espace intercostal gauche ligne axillaire antérieure). Contrairement aux dérivations des membres qui sont bipolaires, les dérivations précordiales sont dites unipolaires. Leur pôle négatif est constitué par une référence virtuelle appelée Borne Centrale de Wilson. Cette borne est obtenue en connectant les trois électrodes des membres (bras droit, bras gauche, jambe gauche) via des résistances, créant ainsi un potentiel moyen quasi nul situé théoriquement au centre du cœur (Figure 7). L’ECG enregistre donc la différence de potentiel entre l’électrode de surface (exploratrice) et ce centre électrique du cœur.
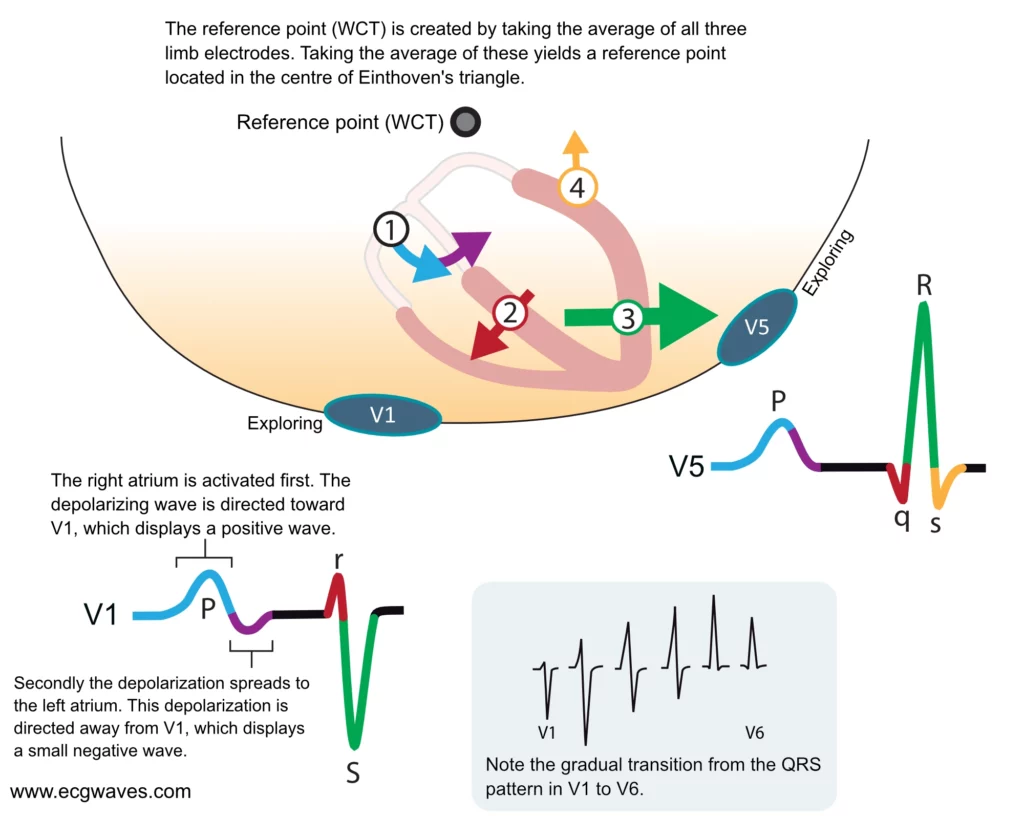
Le premier vecteur : activation auriculaire
Le premier vecteur correspond à la dépolarisation des oreillettes. L’impulsion naît dans le nœud sinusal (paroi haute de l’oreillette droite), puis se propage de manière centrifuge. L’activation de l’oreillette droite génère un vecteur orienté vers l’avant, le bas et légèrement à gauche. Par la suite, via le faisceau de Bachmann, la dépolarisation gagne l’oreillette gauche, orientant le vecteur davantage vers la gauche et vers l’arrière (figure 7). En dérivation V1 (située à droite du sternum), le vecteur initial se dirige vers l’électrode, produisant une première partie de l’onde P positive. Lorsque l’activation atteint l’oreillette gauche (plus postérieure), le vecteur s’éloigne de V1, ce qui peut se traduire par une petite déflexion négative terminale. C’est pourquoi l’onde P en V1 est souvent biphasique (+/-). En revanche, la dérivation V5 (latérale gauche) enregistre des vecteurs s’approchant d’elle durant toute l’activation auriculaire, générant une onde P monophasique et positive.
Le deuxième vecteur : le septum interventriculaire
Une fois l’influx passé par le nœud AV, la dépolarisation ventriculaire débute au mi-septum. Le septum interventriculaire est activé par des fibres de Purkinje issues de la branche gauche du faisceau de His avant celles de la branche droite. Cela entraîne une dépolarisation initiale se propageant physiologiquement de la gauche vers la droite. Le vecteur septal résultant est orienté vers l’avant et la droite. L’électrode V1, située à droite, voit ce vecteur venir vers elle et inscrit une petite onde positive initiale (onde r). L’électrode V5, située à gauche, voit ce vecteur s’éloigner et inscrit une petite onde négative initiale (onde q). C’est l’origine physiologique de l’onde q « septale » fine, normale en V5-V6.
Le troisième vecteur : activation de la paroi libre du ventricule
Après le septum, l’activation gagne les parois libres des deux ventricules simultanément via le réseau de Purkinje. Les vecteurs principaux sont orientés vers la gauche, l’arrière et le bas (figure 7). Cette orientation s’explique par deux facteurs :
- La masse musculaire : Le ventricule gauche étant beaucoup plus massif que le droit, son vecteur électrique prédomine largement et masque celui du ventricule droit. La somme vectorielle pointe donc vers la gauche.
- Le sens de l’activation : L’activation de la paroi libre ventriculaire se fait de l’endocarde (intérieur) vers l’épicarde (extérieur).
Comme l’illustre la figure 7, le vecteur de dépolarisation majeur du ventricule gauche est orienté vers la gauche. L’électrode précordiale V5 enregistre ainsi un vecteur de grande amplitude dirigé vers elle, ce qui se traduit par une grande onde R positive. À l’inverse, l’électrode V1 (à droite) voit ce vecteur puissant s’éloigner d’elle, ce qui génère une onde S profonde et négative.
Le quatrième vecteur : régions basales des ventricules
L’activation ventriculaire se termine par les régions basales (base du cœur) des ventricules droit et gauche. Le vecteur terminal est généralement orienté vers l’arrière, le haut et souvent vers la droite, s’éloignant ainsi de l’électrode V5. Cela peut parfois inscrire une petite onde s terminale en V5. L’électrode V1 enregistre généralement la fin de son onde S ou revient à la ligne isoélectrique.
Le vecteur de l’onde T
L’onde T correspond à la phase de repolarisation ventriculaire rapide (phase 3 du potentiel d’action). Physiologiquement, l’onde T doit être concordante avec le complexe QRS, c’est-à-dire orientée dans la même direction que la déflexion prédominante de celui-ci. Ainsi, un complexe QRS globalement positif (comme en V5) doit être suivi d’une onde T positive. Un complexe QRS globalement négatif (comme en V1) peut être suivi d’une onde T négative ou faiblement positive. Lorsque l’onde T présente une orientation opposée à celle du complexe QRS prédominant (par exemple une onde T négative avec un grand R), on parle d’onde T discordante, ce qui est souvent pathologique (figure 8).

Il existe un paradoxe apparent en électrophysiologie : la dépolarisation et la repolarisation sont des phénomènes électriques inversés (entrée de charges positives vs sortie de charges positives). On pourrait s’attendre à ce que leurs vecteurs soient opposés sur l’ECG (QRS positif donnant une onde T négative). Or, l’onde T est normalement positive comme le QRS. Cette concordance s’explique par le gradient transmural de repolarisation.
Alors que la dépolarisation progresse de l’endocarde vers l’épicarde, la repolarisation suit le chemin inverse : de l’épicarde vers l’endocarde. Cela est dû au fait que les cellules épicardiques possèdent un potentiel d’action plus court que les cellules endocardiques. Elles commencent donc à se repolariser avant que l’endocarde n’ait fini son cycle. Comme illustré dans la Figure 9 :
- Un front de dépolarisation (charges +) avançant vers l’électrode donne une onde positive.
- Un front de repolarisation (retour aux charges -) s’éloignant de l’électrode donne également une onde positive.
En conclusion, puisque (1) les phénomènes ioniques sont inversés (repolarisation) et (2) la direction de propagation est également inversée (épi vers endo), la double négation s’annule : le vecteur de l’onde T pointe dans la même direction que celui du QRS.
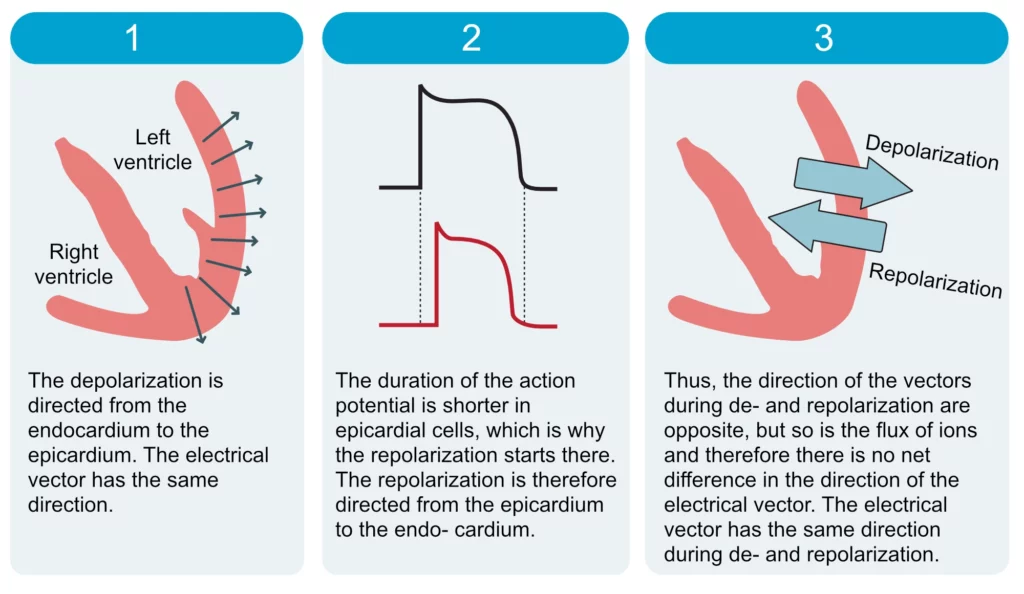
Le vecteur de l’onde T est normalement orienté vers l’avant, légèrement vers la gauche et vers le bas. Des variations physiologiques existent : chez l’enfant et l’adolescent (et parfois la jeune femme), il peut être dirigé davantage vers la gauche et vers l’arrière, entraînant l’apparition d’ondes T négatives dans les dérivations précordiales droites (V1 à V3, voire V4). C’est le pattern d’onde T juvénile. Ces ondes se normalisent généralement au cours de la puberté. Il convient néanmoins de noter qu’une onde T négative isolée en V1 est fréquente chez l’adulte sain et concorde avec la polarité du complexe QRS souvent négatif (rS) dans cette dérivation.
Enfin, on remarquera sur les tracés que les ondes P et T présentent une morphologie arrondie et lisse, tandis que le complexe QRS se caractérise par des déflexions abruptes et pointues. Cette différence s’explique par le contenu fréquentiel du signal : les ondes P et T résultent d’activités électriques relativement lentes et homogènes, alors que le complexe QRS correspond à une propagation explosive et très rapide de l’activation à travers le réseau de Purkinje.