Tachycardie ventriculaire (TV) : critères électrocardiographiques, étiologies, classification et prise en charge
Tachycardie ventriculaire (TV) : classification, étiologies, caractéristiques électrocardiographiques et prise en charge
- Causes et étiologies de la tachycardie ventriculaire
- Présentation clinique
- Tachycardie ventriculaire au cours des syndromes coronariens aigus (infarctus du myocarde)
- Critères électrocardiographiques de la tachycardie ventriculaire
- Types et classification des tachycardies ventriculaires
- Localisation des foyers : corrélation anatomique
- Diagnostic différentiel : TV vs TSV à QRS larges
- Bilan paraclinique et évaluation
- Cas Clinique : Séquence d’un arrêt cardiaque sur TV/FV
- Prise en charge thérapeutique de la tachycardie ventriculaire
- Manuel des médicaments antiarythmiques
- Médicaments antiarythmiques de classe III
- Bêta-bloquants
- Agents de la classe I (Bloqueurs Na+)
- Agents de classe IV (Inhibiteurs calciques)
- Références
Ce chapitre aborde la tachycardie ventriculaire (TV) sous un angle clinique approfondi, en mettant l’accent sur le diagnostic électrocardiographique, les définitions, la stratification du risque et la prise en charge thérapeutique. La tachycardie ventriculaire est une arythmie complexe, prenant naissance au sein du myocarde ventriculaire, en aval de la bifurcation du faisceau de His. Un large éventail de pathologies peut en être à l’origine, et l’ECG reflète cette diversité étiologique par des présentations variées, allant de la TV monomorphe stable à l’orage rythmique. Quelle que soit la cause ou l’aspect électrocardiographique, la tachycardie ventriculaire demeure une urgence diagnostique et thérapeutique. La fréquence ventriculaire est généralement rapide (100 à 250 battements par minute), bien que des TV plus lentes puissent exister, et le débit cardiaque est presque toujours compromis par la perte de la synchronisation atrio-ventriculaire et le raccourcissement de la diastole. Cette arythmie impose au myocarde ventriculaire un stress hémodynamique et métabolique considérable, alors même que la pathologie sous-jacente (ischémie, fibrose, inflammation) altère déjà la fonction cellulaire. Cette situation favorise une instabilité électrique majeure pouvant évoluer vers une fibrillation ventriculaire (FV). En l’absence de traitement immédiat, la dégénérescence en fibrillation ventriculaire conduit inéluctablement à l’asystolie et à l’arrêt cardiaque. Il est donc impératif que tous les cliniciens, urgentistes, internistes et cardiologues, maîtrisent la reconnaissance et la prise en charge initiale d’une TV.
Causes et étiologies de la tachycardie ventriculaire
Les patients présentant une tachycardie ventriculaire souffrent majoritairement d’une cardiopathie structurelle sous-jacente. L’identification de l’étiologie est cruciale car elle guide non seulement le traitement aigu mais aussi la prévention secondaire (défibrillateur, ablation, traitement médical). Les étiologies les plus fréquentes incluent la maladie coronarienne (syndromes coronariens aigus ou séquelles d’infarctus constituant le substrat de réentrée), l’insuffisance cardiaque à fraction d’éjection réduite, les cardiomyopathies — notamment la cardiomyopathie dilatée (CMD), la cardiomyopathie hypertrophique (CMH) — ainsi que les valvulopathies évoluées.
Parmi les causes moins fréquentes mais importantes à diagnostiquer, figurent la cardiomyopathie ou dysplasie arythmogène du ventricule droit (ARVC/ARVD), la sarcoïdose cardiaque, la myocardite (aiguë ou chronique), l’angor de Prinzmetal (vasospasme coronarien), les troubles électrolytiques sévères (hypokaliémie, hypomagnésémie), certaines cardiopathies congénitales opérées (tétralogie de Fallot) et la tachycardie ventriculaire induite par les catécholamines.
Il existe également une catégorie spécifique de TV liées aux canalopathies héréditaires sur cœur structurellement sain, telles que le syndrome de Brugada, le syndrome du QT long congénital, le syndrome du QT court et la tachycardie ventriculaire polymorphe catécholergique (TVPC). Ces pathologies exposent particulièrement au risque de mort subite chez le sujet jeune.
La majorité des patients présentant une TV documentée ont une cardiopathie ischémique, une insuffisance cardiaque ou une cardiomyopathie. Dans ces populations, l’altération de la fonction ventriculaire gauche constitue l’un des principaux facteurs prédictifs de mort subite d’origine cardiaque. Les patients dont la fraction d’éjection ventriculaire gauche (FEVG) est altérée — particulièrement si elle est inférieure à 35-40 % — présentent un risque substantiellement élevé d’arythmie ventriculaire maligne.
Tachycardie ventriculaire idiopathique (TVI)
La tachycardie ventriculaire est qualifiée d’idiopathique lorsqu’aucune étiologie structurelle, métabolique ou génétique identifiable n’est mise en évidence après un bilan complet (incluant échocardiographie, et souvent IRM cardiaque). Ce type de tachycardie ventriculaire, qui représente environ 10 % des cas de TV, présente généralement un pronostic nettement plus favorable que les formes secondaires à une cardiopathie structurelle. Elles surviennent souvent chez des patients jeunes et sont moins susceptibles de dégénérer en fibrillation ventriculaire, bien que des formes malignes existent. Les deux formes les plus courantes sont la TV infundibulaire (voie de sortie) et la TV fasciculaire.
Mécanismes électrophysiologiques
La compréhension des mécanismes sous-jacents est essentielle pour le choix thérapeutique (médicaments vs ablation). La tachycardie ventriculaire (TV) peut résulter de trois mécanismes principaux :
- La réentrée (Reentry) : C’est le mécanisme le plus fréquent, responsable de la majorité des TV sur cardiopathie structurelle (post-infarctus, cardiomyopathie dilatée). Elle nécessite un substrat anatomique comportant une zone de conduction lente (souvent au sein d’une cicatrice fibreuse) et un bloc de conduction unidirectionnel. L’impulsion électrique tourne autour d’un obstacle anatomique ou fonctionnel.
- L’automaticité anormale : Elle résulte d’une dépolarisation spontanée diastolique accélérée de cellules ventriculaires (foyer ectopique). Ce mécanisme est souvent impliqué dans la phase aiguë de l’ischémie myocardique ou dans certains troubles électrolytiques.
- L’activité déclenchée (Triggered activity) : Elle est due à des oscillations du potentiel de membrane (post-dépolarisations précoces ou tardives). Ce mécanisme est typique des TV survenant dans le cadre du syndrome du QT long (torsades de pointes), de l’intoxication digitalique ou de la surcharge calcique intracellulaire.
Comme mentionné précédemment, la TV induit un compromis hémodynamique variable. La perte de la contribution atriale au remplissage ventriculaire (« kick » auriculaire), associée à une fréquence ventriculaire élevée et à une dyssynchronie de contraction, limite drastiquement le volume d’éjection systolique et, par conséquent, le débit cardiaque.
Présentation clinique
Le spectre clinique de la tachycardie ventriculaire est extrêmement large. La tolérance hémodynamique dépend essentiellement de trois facteurs : la fréquence de la tachycardie, la fonction ventriculaire gauche sous-jacente et la présence de mécanismes compensateurs périphériques.
- TV bien tolérée : Certains patients, notamment ceux avec une TV lente (100-140 bpm) ou une fonction cardiaque préservée, peuvent ne ressentir que des palpitations, une dyspnée légère ou une gêne thoracique. Attention : une bonne tolérance hémodynamique initiale ne doit jamais faire éliminer le diagnostic de TV. Le dogme « le patient est stable, donc ce n’est pas une TV » est une erreur clinique dangereuse.
- TV mal tolérée : La plupart des patients présentent une hypotension, une présyncope, une syncope, une angine de poitrine ou des signes d’insuffisance cardiaque aiguë (OAP).
- Arrêt cardiaque : Dans ses formes fulminantes ou prolongées, la tachycardie ventriculaire peut évoluer vers une fibrillation ventriculaire, conduisant à l’asystolie et au décès.
Le traitement de la TV et la prévention de la mort subite (par défibrillateur implantable) constituent des progrès majeurs de la cardiologie moderne. L’avènement des unités de soins intensifs coronariens dans les années 1960 a permis de réduire drastiquement la mortalité hospitalière de l’infarctus, initialement dominée par les troubles du rythme ventriculaires.
Tachycardie ventriculaire au cours des syndromes coronariens aigus (infarctus du myocarde)
Les syndromes coronariens aigus se divisent en trois entités : l’angor instable (UA), l’infarctus du myocarde avec sus-décalage du segment ST (STEMI) et l’infarctus du myocarde sans sus-décalage du segment ST (NSTEMI). Le risque de tachycardie ventriculaire (TV) est particulièrement élevé dans ces situations, atteignant son maximum durant la phase hyperaiguë. La TV polymorphe ou la fibrillation ventriculaire primaire (survenant dans les 24-48h) est liée à l’ischémie aiguë et ne péjore pas nécessairement le pronostic à long terme si le patient survit à l’événement initial. En revanche, les TV survenant tardivement (après 48h) sont souvent liées à une nécrose étendue et à une dysfonction ventriculaire gauche sévère, assombrissant le pronostic.
Critères électrocardiographiques de la tachycardie ventriculaire
Caractéristiques électrocardiographiques générales
- Une tachycardie ventriculaire est définie par la survenue d’au moins trois battements ventriculaires consécutifs, avec une fréquence comprise entre 100 et 250 battements par minute (généralement supérieure à 120 bpm).
- Lorsque la fréquence se situe entre 100 et 120 bpm, on parle de tachycardie ventriculaire lente ou de rythme idioventriculaire accéléré (RIVA), souvent observé lors de la reperfusion coronaire.
- Au-delà de 250 bpm, l’activité électrique devient sinusoïdale, sans distinction nette entre QRS et onde T : on utilise le terme de flutter ventriculaire.
- Complexes QRS larges : La durée est par définition ≥ 0,12 s. Cependant, dans la majorité des TV sur cœur malade, la durée dépasse 0,14 s voire 0,16 s. Plus le QRS est large, plus l’origine ventriculaire est probable.
Types et classification des tachycardies ventriculaires
L’électrocardiogramme (ECG) permet de distinguer et de sous-classer différents types de tachycardies ventriculaires, ce qui a une implication directe sur la prise en charge.
Tachycardie ventriculaire, soutenue ou non soutenue
La distinction temporelle est fondamentale :
- TV non soutenue (TVNS) : Trois battements ou plus, s’arrêtant spontanément en moins de 30 secondes. Elle peut être asymptomatique mais témoigne souvent d’une cardiopathie sous-jacente.
- TV soutenue (TVS) : Durée supérieure à 30 secondes OU nécessitant une intervention (cardioversion) avant 30 secondes en raison d’une instabilité hémodynamique. C’est une urgence vitale.
Tachycardie ventriculaire monomorphe
Dans la tachycardie ventriculaire monomorphe, l’ensemble des complexes QRS présente une morphologie identique cycle après cycle. Cette stabilité morphologique suggère une séquence d’activation ventriculaire constante, typique d’un mécanisme de réentrée autour d’une cicatrice fixe. C’est la forme la plus classique chez le patient coronarien chronique (post-infarctus).

Les fibres de Purkinje peuvent également être impliquées. La TV fasciculaire est une forme spécifique de TV idiopathique :
- TV fasciculaire (Belhassen) : Réentrée utilisant le fascicule postérieur gauche. Elle survient chez des sujets jeunes (souvent hommes), sur cœur sain. L’ECG montre typiquement un aspect de bloc de branche droit (BBD) avec axe gauche. Elle répond spécifiquement au Vérapamil.
- TV de la voie de sortie (RVOT/LVOT) : C’est la forme la plus fréquente de TV idiopathique. Le foyer se situe souvent dans la voie d’éjection du ventricule droit. L’ECG montre un aspect de retard gauche (BBG) avec un axe inférieur (positif en DII, DIII, aVF), car l’activation part du haut vers le bas. Ces TV sont souvent sensibles à l’adénosine et aux bêta-bloquants. Voir figure 2.

Tachycardie ventriculaire polymorphe
Une tachycardie ventriculaire caractérisée par une variation continue de la morphologie des QRS et/ou de l’axe électrique est classée comme polymorphe. Elle est généralement très rapide (> 200 bpm) et instable. Contrairement à la TV monomorphe (souvent liée à une cicatrice fixe), la TV polymorphe suggère une instabilité électrique aiguë, souvent ischémie ou canalopathie.
La Torsade de Pointes (TdP) est une forme spécifique de TV polymorphe survenant dans un contexte d’allongement de l’intervalle QT (congénital ou acquis). Elle se caractérise par une rotation de la pointe des QRS autour de la ligne isoélectrique.
La tachycardie ventriculaire polymorphe catécholaminergique familiale (TVPC) et le syndrome de Brugada sont des causes génétiques rares mais importantes de TV polymorphes. La TV bidirectionnelle, illustrée ci-dessous, est pathognomonique de la TVPC ou de l’intoxication digitalique : elle montre une alternance de l’axe frontal du QRS d’un battement à l’autre.

Localisation des foyers : corrélation anatomique
L’ECG permet de localiser approximativement le site de sortie de la TV. La règle simple repose sur la morphologie de « bloc de branche » en V1 :
- Retard Gauche (Aspect BBG, onde S dominante en V1) : L’activation part du ventricule droit (VD) pour aller vers le gauche. Origine probable : Ventricule droit (ou septum interventriculaire).
- Retard Droit (Aspect BBD, onde R dominante en V1) : L’activation part du ventricule gauche (VG) pour aller vers le droit. Origine probable : Ventricule gauche.
Cette distinction est précieuse pour orienter le diagnostic étiologique (ex: une morphologie retard gauche chez un jeune patient évoque une dysplasie du VD ou une TV infundibulaire).


Diagnostic différentiel : TV vs TSV à QRS larges
Le diagnostic différentiel d’une tachycardie à complexes larges (>120ms) est un défi clinique majeur. Les deux principales possibilités sont la Tachycardie Ventriculaire (TV) et la Tachycardie Supraventriculaire (TSV) avec conduction aberrante (bloc de branche fonctionnel ou organique préexistant).
Règle d’or clinique : Toute tachycardie à QRS larges doit être considérée comme une tachycardie ventriculaire jusqu’à preuve du contraire. Statistiquement, plus de 80 % des tachycardies à QRS larges sont des TV, et ce chiffre dépasse 90 % chez les patients ayant des antécédents d’infarctus du myocarde. Traiter une TV comme une TSV (ex: administration de Vérapamil) peut entraîner un collapsus cardiovasculaire fatal.
Les critères électrocardiographiques de la TV sont les suivants :
1. Dissociation auriculo-ventriculaire (AV)
C’est le critère le plus spécifique (100 %). Les ventricules battent rapidement (source de la tachycardie) tandis que les oreillettes battent à leur propre rythme (sinusal), plus lent. Il faut rechercher activement des ondes P « dissociées », qui « marchent à travers » les QRS. Le signe de la dissociation AV peut être difficile à voir sur un ECG de surface standard.

2. Battements de fusion et de capture
Ce sont des conséquences directes de la dissociation AV et ils confirment le diagnostic de TV :
- Battement de capture : Une onde P sinusale parvient fortuitement à traverser le nœud AV alors que les ventricules ne sont pas réfractaires, produisant un QRS fin (normal) au milieu de la tachycardie à QRS larges.
- Battement de fusion : Le ventricule est activé simultanément par l’influx sinusal descendant et par le foyer ectopique ventriculaire. Le QRS résultant a une morphologie intermédiaire (hybride).

3. Autres critères distinctifs
- Concordance précordiale : Tous les QRS de V1 à V6 sont de même polarité (tous positifs ou tous négatifs). Une concordance négative est très spécifique de la TV.
- Axe hyper-droit (North-West axis) : Un axe électrique entre -90° et -180° est quasi exclusif à la TV.
- Largeur du QRS : Plus le QRS est large, plus la TV est probable. >140 ms pour un aspect BBD et >160 ms pour un aspect BBG sont de forts prédicteurs.


Algorithme diagnostique de Brugada
Les critères morphologiques ont été systématisés par les frères Brugada dans un algorithme séquentiel en 4 étapes, à appliquer face à une tachycardie régulière à QRS larges.
- Absence de complexe RS dans les précordiales ? Si aucun complexe RS n’est visible de V1 à V6 (c’est-à-dire concordance pure R ou pure S), le diagnostic est une TV. Sinon, passer à l’étape suivante.
- Intervalle RS > 100 ms ? Mesurez l’intervalle entre le début de l’onde R et le nadir de l’onde S dans une dérivation précordiale. Si > 100 ms, c’est une TV. Sinon, étape suivante.
- Dissociation atrio-ventriculaire ? Si visible, c’est une TV. Sinon, étape suivante.
- Critères morphologiques en V1/V2 et V6 ? Analysez la morphologie spécifique (voir détails ci-dessous). Si compatible avec TV, le diagnostic est posé. Sinon, c’est une TSV avec aberration.
Détails des critères morphologiques (Étape 4)
En cas de retard Droit (V1 positif) :
- V1 : Aspect monophasique (R), biphasique (qR) ou triphasique avec onde R initiale > onde r’ (signe de l’oreille de lapin gauche plus grande).
- V6 : Aspect QS, R/S < 1, ou onde R monophasique.
En cas de retard Gauche (V1 négatif) :
- V1/V2 : Onde R initiale large (> 30-40ms), empâtement de la branche descendante de l’onde S (signe de Josephson), délai au nadir de l’onde S > 60 ms.
- V6 : Présence d’une onde q (qR) ou aspect QS.
Bilan paraclinique et évaluation
Une fois la tachycardie ventriculaire stabilisée, un bilan étiologique exhaustif est indispensable pour guider la stratégie thérapeutique à long terme.
- Échocardiographie transthoracique (ETT) : Examen de première intention. Elle évalue la FEVG, recherche des troubles de la cinétique segmentaire (séquelles d’infarctus), une hypertrophie, une dilatation du VD (ARVC) ou une valvulopathie.
- Coronarographie : Indiquée quasi-systématiquement chez l’adulte pour rechercher une ischémie active ou définir l’anatomie coronaire avant revascularisation.
- IRM cardiaque : Devenue incontournable, elle permet de visualiser les zones de fibrose (rehaussement tardif au gadolinium) qui constituent le substrat de l’arythmie, notamment dans les cardiomyopathies non ischémiques et les myocardites.
- Tests génétiques : Indiqués en cas de suspicion de canalopathie (QT long, Brugada) ou de cardiomyopathie familiale (ARVC, CMH).
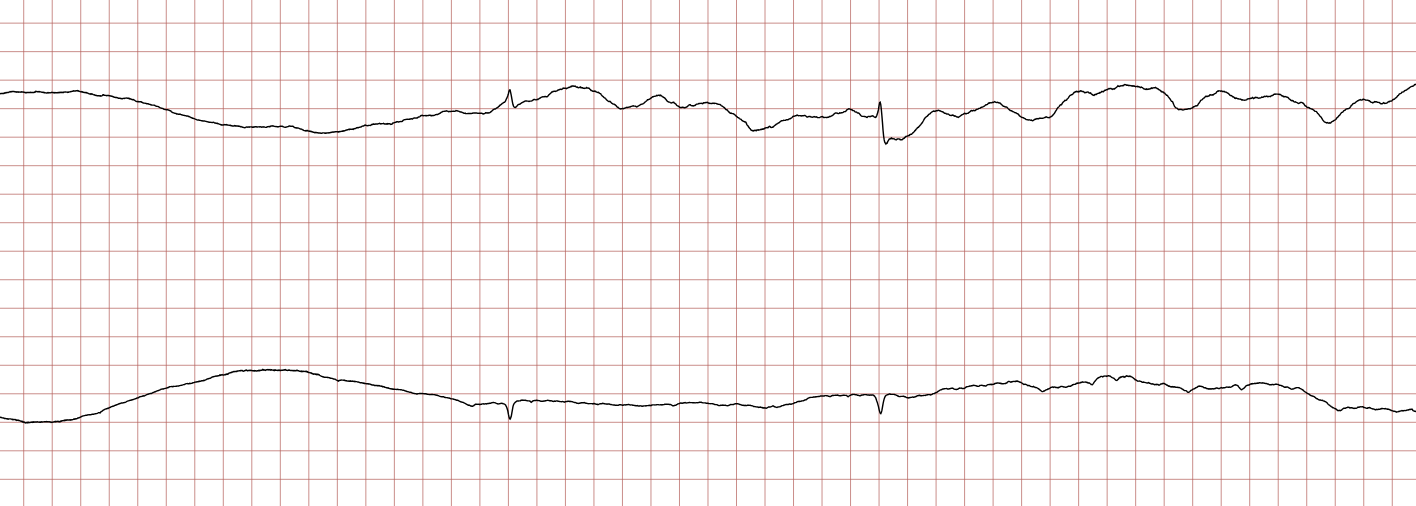
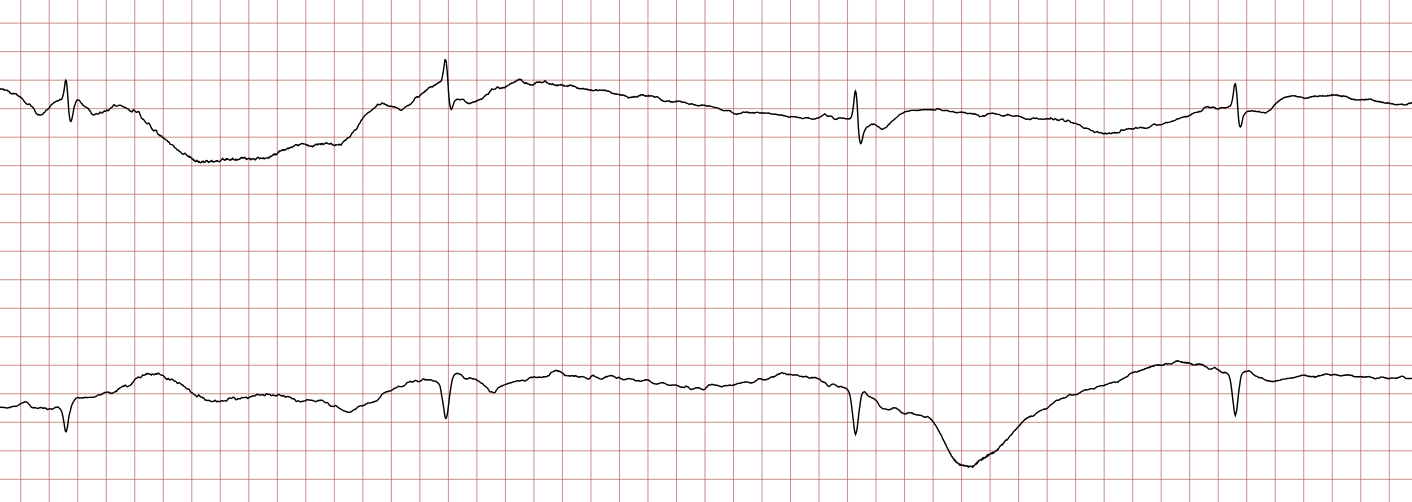
Cas Clinique : Séquence d’un arrêt cardiaque sur TV/FV
Enregistrement Holter d’un patient de 62 ans, coronarien connu. La séquence montre la dégénérescence rythmique classique menant à la mort subite : TV polymorphe -> FV grossière -> FV fine -> Asystolie, puis récupération après choc électrique.
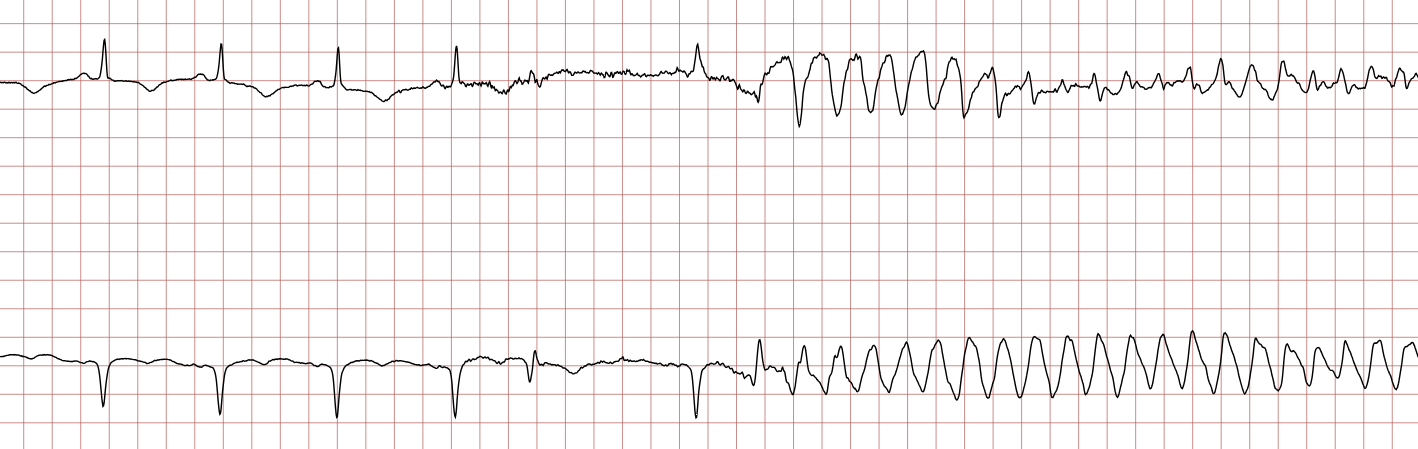
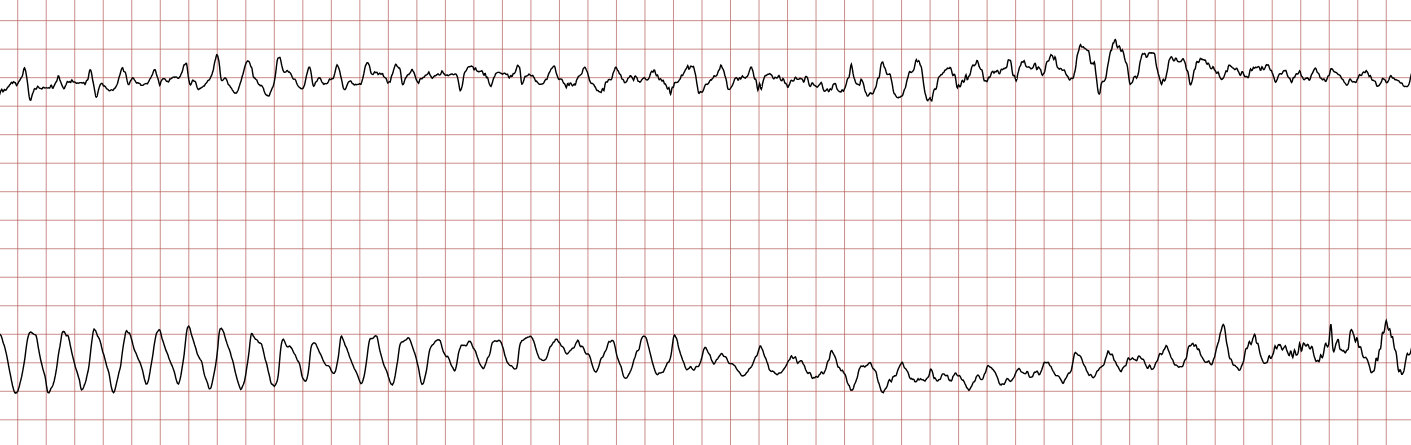
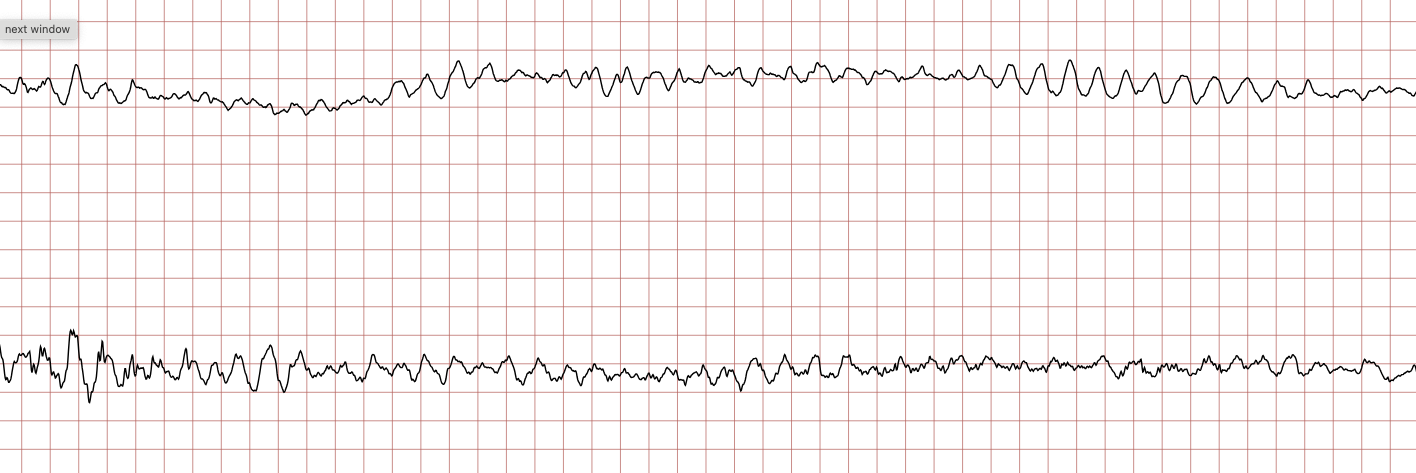
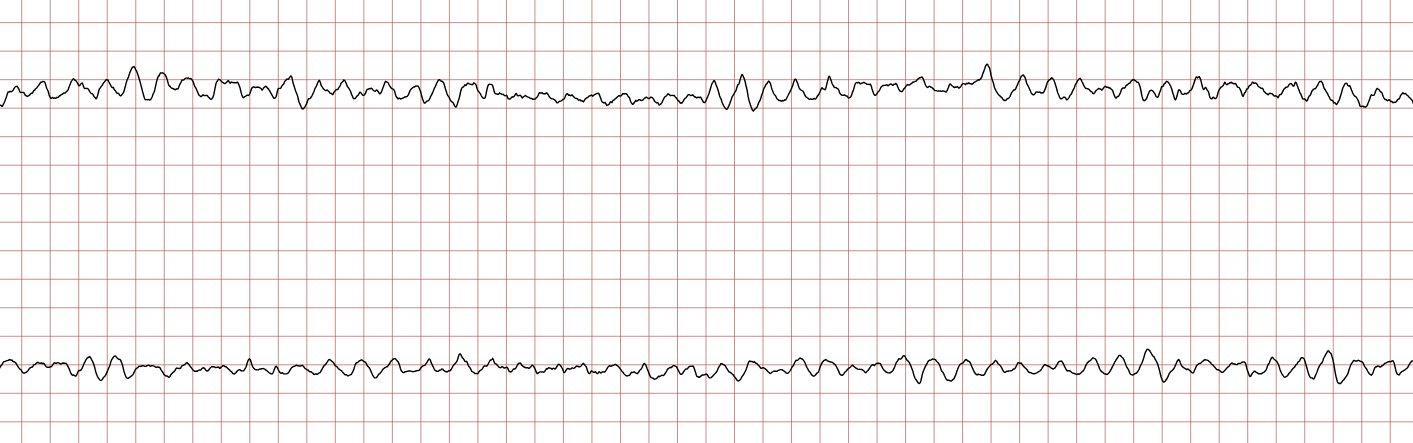
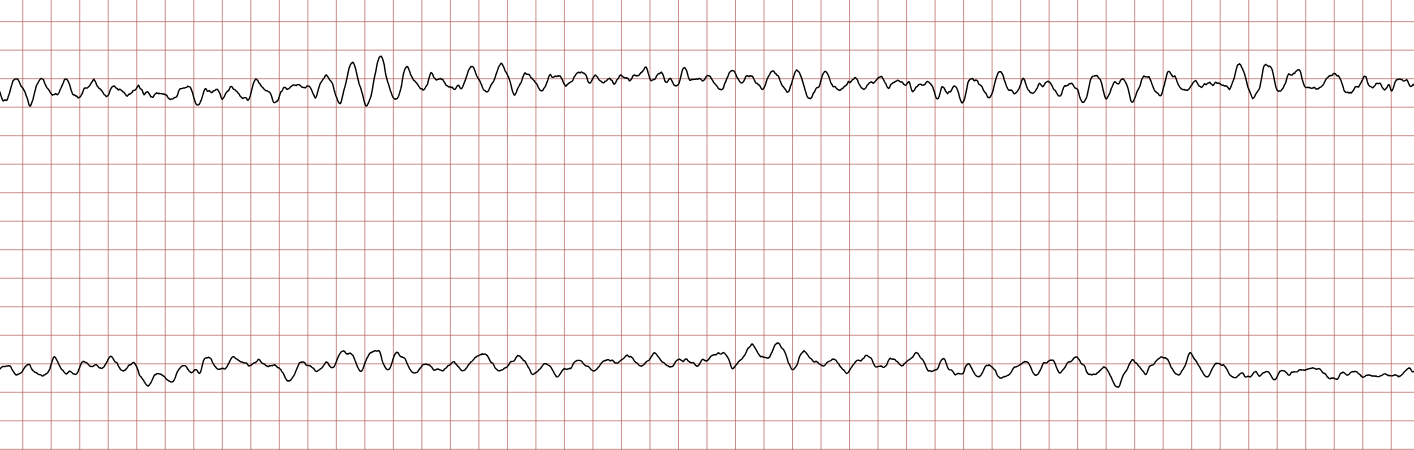
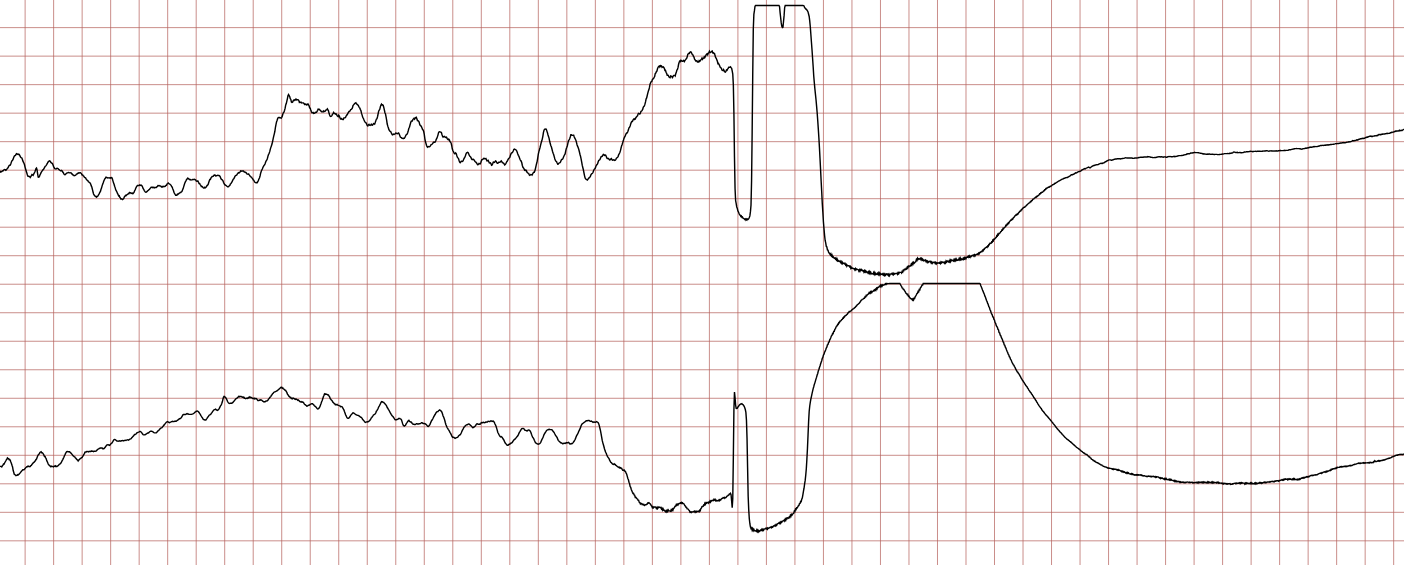
Log in to view image, video, quiz, text
ECG 7. Asystolie après le choc.
Prise en charge thérapeutique de la tachycardie ventriculaire
La prise en charge de la tachycardie ventriculaire doit être structurée en trois phases : le traitement aigu de l’épisode, l’évaluation du risque de récidive et la prévention à long terme (médicale et interventionnelle).
1. Traitement aigu de l’épisode de TV
La stratégie immédiate dépend exclusivement de la tolérance hémodynamique.
- Patient instable (hypotension sévère, troubles de la conscience, OAP) :
- Choc électrique externe (Cardioversion) synchronisé immédiat. En cas de perte de pouls, débuter la réanimation cardio-pulmonaire (ACLS) et défibriller.
- Patient stable :
- La cardioversion électrique sous sédation reste une option de choix et très efficace.
- La cardioversion pharmacologique peut être tentée. L’Amiodarone (300 mg IV sur 20-60 min) ou la Procaïnamide (si disponible) sont les agents de choix. La Lidocaïne est moins efficace dans la TV monomorphe stable mais utile en cas d’ischémie.
2. Prévention à long terme et dispositifs implantables
Le but principal est la prévention de la mort subite.
- Défibrillateur Automatique Implantable (DAI) : C’est la pierre angulaire de la thérapie.
- Prévention secondaire : Indiqué chez tout patient survivant d’un arrêt cardiaque ou d’une TV mal tolérée sans cause réversible aiguë.
- Prévention primaire : Indiqué chez les patients insuffisants cardiaques avec FEVG ≤ 35% malgré un traitement médical optimal (attendre 40 jours post-infarctus).
- Ablation par radiofréquence :
- Elle est curative et de première intention pour les TV idiopathiques (RVOT, fasciculaire).
- Pour les TV sur cardiopathie ischémique, elle est indiquée en cas de chocs répétés du DAI ou d’orage rythmique, pour réduire la charge arythmique, bien qu’elle ne remplace pas toujours le besoin d’un DAI.
3. Principes pharmacologiques spécifiques
- Il faut toujours rechercher et corriger les causes réversibles (ischémie, hypokaliémie).
- Chez les patients avec cardiopathie structurelle, seuls l’amiodarone et les bêta-bloquants sont considérés comme sûrs pour un traitement au long cours. Les antiarythmiques de classe IC (Flécaïnide) sont contre-indiqués en post-infarctus (étude CAST).
- Les bêta-bloquants sont les seuls antiarythmiques ayant démontré un bénéfice clair sur la mortalité globale et la prévention de la mort subite.
- Orage rythmique (Electrical Storm) : Défini par ≥ 3 épisodes de TV/FV en 24h. C’est une urgence vitale nécessitant une sédation, un blocage sympathique intense (bêta-bloquants non sélectifs comme le Propranolol), de l’Amiodarone et souvent une ablation en urgence.
Cas particulier : Tachycardie ventriculaire non soutenue (TVNS)
- Cœur sain : Généralement bénigne. Traitement par bêta-bloquants uniquement si symptomatique.
- Cardiopathie structurelle : Marqueur de risque de mort subite. Ne nécessite pas forcément de traitement antiarythmique spécifique (amiodarone) si asymptomatique, mais impose d’optimiser le traitement de l’insuffisance cardiaque et de discuter l’indication d’un DAI.
Cas particulier : Torsade de pointes (QT long)
Le traitement diffère radicalement des autres TV :
- Sulfate de magnésium 2 g IV direct, systématique.
- Accélération de la fréquence cardiaque (Pacing ou Isoprénaline) pour raccourcir le QT.
- Correction agressive de l’hypokaliémie (> 4.5 mmol/L).
- Contre-indication formelle à l’Amiodarone et aux autres agents allongeant le QT.
Manuel des médicaments antiarythmiques
Ce guide répertorie les principales molécules utilisées. Notez que la classification de Vaughan-Williams a ses limites cliniques.
Médicaments antiarythmiques de classe III
Amiodarone
| Médicament | Amiodarone |
| Nom de marque | Cordarone |
| Indications | TV stable, FV réfractaire, Prévention récidive, Orage rythmique. |
| Mécanisme d’action | Classe III prédominante (K+ block), mais possède des effets I, II et IV. |
| Effets ECG | Bradycardie, allongement PR, QRS, et surtout QT. |
| Administration | IV (Voie centrale préférée pour éviter phlébite), PO |
| Dose | Arrêt cardiaque (FV/TV) : 300 mg IV direct, puis 150 mg si besoin. TV stable : Dose de charge 150 mg sur 10-20 min, puis perfusion continue (environ 1000 mg/24h). Entretien PO : 200 mg/j (après dose de charge cumulative de 10g). |
| Précautions | Surveillance thyroïdienne, pulmonaire et hépatique au long cours. |
Sotalol
| Médicament | Sotalol |
| Nom de marque | Sotalex |
| Indications | Prévention des récidives de TV (si FEVG préservée ou peu altérée), FA. |
| Mécanisme d’action | Bêta-bloquant avec effet de classe III (bloc K+). |
| Effets ECG | Bradycardie, Allongement du QT (risque de Torsades). |
| Dose | 80 à 160 mg x 2/jour. Ajustement strict à la fonction rénale. |
| Contre-indications | QT long, Insuffisance rénale sévère, Insuffisance cardiaque décompensée. |
Bêta-bloquants
Les bêta-bloquants (Métoprolol, Bisoprolol, Carvédilol, Nadolol) constituent le socle du traitement de fond. Le Nadolol est particulièrement indiqué dans le QT long congénital et la TVPC. L’Esmolol (IV ultra-court) est utile en phase aiguë d’instabilité.
Agents de la classe I (Bloqueurs Na+)
Lidocaïne (Classe IB)
| Médicament | Lidocaïne |
| Indications | TV ischémique aiguë, Orage rythmique post-infarctus, Torsades de pointes. |
| Mécanisme | Bloc Na+ rapide. Efficacité préférentielle sur le tissu ischémié. |
| Dose | Bolus : 1 à 1,5 mg/kg IV direct. Perfusion : 1 à 4 mg/min. |
| Avantage | Peu d’effet hypotenseur, pas d’allongement du QT. |
Flécaïnide (Classe IC)
| Médicament | Flécaïnide |
| Indications | TV sur cœur sain (RVOT), TVPC. |
| Contre-indication majeure | Tout patient avec cardiopathie structurelle (Coronaropathie, Dysfonction VG). Risque pro-arythmique mortel. |
Agents de classe IV (Inhibiteurs calciques)
Le Vérapamil et le Diltiazem sont contre-indiqués dans les TV à complexes larges indifférenciées car ils peuvent précipiter le collapsus en cas de dysfonction VG. Leur usage est réservé aux TV fasciculaires idiopathiques confirmées (Vérapamil-sensibles).
Références
Zipes DP, Camm AJ, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2006.
Priori SG, Blomström-Lundqvist C, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europace 2015.
Zeppenfeld K, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J 2022.
Al-Khatib SM, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death. Circulation 2018.