Infarctus du myocarde sans sus-décalage du segment ST (NSTEMI) et angine instable : Diagnostic, critères, ECG, prise en charge
Syndromes coronariens aigus sans sus-décalage du segment ST (NSTE-ACS) : infarctus du myocarde sans sus-décalage du segment ST (NSTEMI) et angor instable (UA)
- Définitions et classification des syndromes coronariens aigus (infarctus aigu du myocarde)
- Épidémiologie de l’infarctus du myocarde sans sus-décalage du segment ST et de l’angor instable
- Physiopathologie : l’occlusion partielle et la vulnérabilité myocardique
- Complications aiguës et à long terme de l’infarctus du myocarde de type NSTEMI et de l’angor instable
- ECG dans l’infarctus du myocarde de type NSTEMI et l’angor instable
- Évaluation clinique et évaluation initiale des patients souffrant d’un NSTEMI et d’un angor instable
- Thérapies médicamenteuses fondées sur des données probantes
- Stratégie Invasive et Revascularisation
Ce chapitre est consacré au diagnostic approfondi et à la prise en charge thérapeutique des patients présentant un infarctus du myocarde sans sus-décalage du segment ST (NSTEMI) et un angor instable (UA), collectivement regroupés sous l’acronyme NSTE-ACS (syndromes coronariens aigus sans sus-décalage du segment ST). Nous aborderons en détail la physiopathologie complexe de la rupture de plaque et de l’érosion, la définition clinique précise, les critères diagnostiques biologiques et électriques, ainsi que la stratification du risque et la prise en charge invasive. Bien que les modifications de l’ECG dans le NSTEMI et l’angor instable aient été abordées dans les sections précédentes, une révision systématique des critères ECG et des diagnostics différentiels est proposée ici. La prise en charge pharmacologique et interventionnelle du NSTEMI et de l’angor instable sera discutée à la lumière des dernières preuves scientifiques. Les définitions cliniques et les recommandations présentées dans ce chapitre sont alignées sur les lignes directrices contemporaines de l’American Heart Association (AHA), de l’American College of Cardiology (ACC) et de la Société Européenne de Cardiologie (ESC 2020/2023). Le chapitre débutera par les concepts fondamentaux avant de détailler les algorithmes décisionnels complexes.
Comme pour l’infarctus du myocarde avec sus-décalage du segment ST (STEMI) et l’angor instable, la caractéristique clinique dominante demeure la douleur thoracique (gêne rétrosternale constrictive). Cependant, la présentation clinique peut être trompeuse. La douleur thoracique causée par le NSTEMI et l’angor instable peut être moins intense ou présenter des caractéristiques atypiques par rapport au STEMI. Cela s’explique physiopathologiquement par le fait que le NSTEMI et l’angor instable résultent généralement d’une thrombose non occlusive ou d’une occlusion transitoire des artères coronaires ; cette obstruction partielle entraîne une réduction critique du flux sanguin coronaire sans arrêt total, provoquant une ischémie sous-endocardique. Le sous-endocarde, étant la couche la plus distale par rapport aux artères épicardiques et soumise aux pressions pariétales les plus élevées, est le plus vulnérable à l’ischémie. À l’inverse, le STEMI résulte d’une occlusion complète et persistante, conduisant à une ischémie transmurale rapide. Néanmoins, il est crucial de noter que la sévérité des symptômes ne corrèle pas toujours avec la gravité de l’atteinte anatomique ; un NSTEMI peut être associé à une maladie pluritronculaire sévère ou à une sténose du tronc commun.
Outre la douleur thoracique, l’anamnèse doit rechercher des équivalents angineux. Des symptômes tels que la dyspnée d’effort ou de repos, des sueurs froides (diaphorèse), des nausées, des vomissements, ou une syncope sont fréquents, particulièrement chez les femmes, les patients âgés (> 75 ans), et les diabétiques. Ces présentations atypiques retardent souvent le diagnostic et sont associées à un pronostic plus sombre. La reconnaissance rapide de ces signes est vitale pour initier la cascade thérapeutique.
Comme pour les patients souffrant d’un infarctus avec sus-décalage du segment ST, les patients présentant un NSTE-ACS courent un risque significatif de développer des arythmies ventriculaires malignes (tachycardie ventriculaire, fibrillation ventriculaire) pouvant conduire à la mort subite. Bien que le risque arythmique absolu soit légèrement inférieur à celui de la phase aiguë du STEMI, il reste une préoccupation majeure, justifiant une surveillance monitorée immédiate. La majorité des décès précoces sont d’origine rythmique et surviennent dans les premières heures suivant l’apparition des symptômes, soulignant l’impératif d’une médicalisation préhospitalière rapide.
NSTEMI et angor instable : continuum physiopathologique
L’infarctus du myocarde de type NSTEMI et l’angor instable se distinguent sur un point fondamental biologique : le NSTEMI est défini par la présence d’une nécrose myocardique, objectivée par l’élévation des biomarqueurs cardiaques (troponine), alors que l’angor instable est un syndrome ischémique aigu sans libération détectable de marqueurs de nécrose. L’angor instable n’est diagnostiqué que s’il n’y a pas de preuve biochimique d’infarctus du myocarde malgré des symptômes ischémiques au repos ou crescendo. Toutefois, avec l’avènement des troponines ultra-sensibles (hs-cTn), le diagnostic d’angor instable devient de plus en plus rare, car ces tests détectent des micro-nécroses qui passaient auparavant inaperçues, reclassant ainsi ces patients en NSTEMI.
L’angor instable reste un diagnostic clinique critique car il signale une plaque d’athérosclérose instable susceptible de se rompre complètement à tout moment. Environ 50 % des patients souffrant d’angor instable non traités évoluent vers un infarctus du myocarde franc dans les 30 jours. La physiopathologie du NSTEMI et de l’angor instable est superposable : rupture ou érosion de plaque athéromateuse, formation d’un thrombus plaquettaire riche en fibrine, embolisation distale de micro-agrégats et vasospasme associé. La prise en charge initiale est donc identique (antiagrégants, anticoagulants), la distinction finale reposant sur la biologie.
La chaîne de soins et la logistique pré-hospitalière
La prise en charge des syndromes coronariens aigus est guidée par le principe que le temps, c’est du muscle, bien que cette notion soit plus critique dans le STEMI. Pour le NSTE-ACS, le délai est également important pour prévenir l’extension de l’ischémie, l’instabilité électrique et la progression vers l’occlusion totale. Une approche systématisée régionale est indispensable. Le premier contact médical (PCM) doit permettre :
- Un diagnostic rapide par ECG 12 dérivations (pour exclure un STEMI nécessitant une reperfusion immédiate).
- L’initiation du traitement médicamenteux.
- Le choix de la stratégie d’orientation (centre avec ou sans capacité d’angioplastie) basé sur la stratification du risque.
Les unités de soins intensifs cardiologiques (USIC) et les laboratoires de cathétérisme doivent collaborer étroitement pour offrir une stratification invasive adaptée au risque individuel du patient.
Principes généraux de la prise en charge
La stratégie thérapeutique moderne du NSTE-ACS repose sur trois piliers : le traitement anti-ischémique (pour réduire la consommation myocardique en oxygène), le traitement antithrombotique (double antiagrégation plaquettaire et anticoagulation parentérale pour passiver la plaque), et la revascularisation coronaire (généralement par intervention coronarienne percutanée, ICP). Contrairement au STEMI où l’angiographie est immédiate, le moment de l’angiographie dans le NSTE-ACS est modulé par le risque. Les recommandations actuelles (ESC) préconisent une stratégie invasive précoce (dans les 24h) pour les patients à haut risque (changements ECG dynamiques, élévation de la troponine, score GRACE > 140). Les patients à très haut risque (instabilité hémodynamique, douleur réfractaire) requièrent une angiographie immédiate (< 2h), comparable à un STEMI. Les patients à faible risque peuvent bénéficier d'une stratégie invasive sélective ou d'un test d'ischémie préalable. La gestion au long cours inclut une prévention secondaire agressive (statines de haute intensité, contrôle strict du diabète et de l'hypertension).
Définitions et classification des syndromes coronariens aigus (infarctus aigu du myocarde)
Le terme de syndrome coronarien aigu (SCA) englobe un spectre clinique causé par une réduction brutale et critique du flux sanguin coronarien. Le mécanisme prédominant est l’athérothrombose : la rupture ou l’érosion d’une plaque d’athérosclérose expose le collagène sous-endothélial et le facteur tissulaire au sang circulant, déclenchant l’activation plaquettaire et la cascade de coagulation. La figure 1 illustre ce processus dynamique.
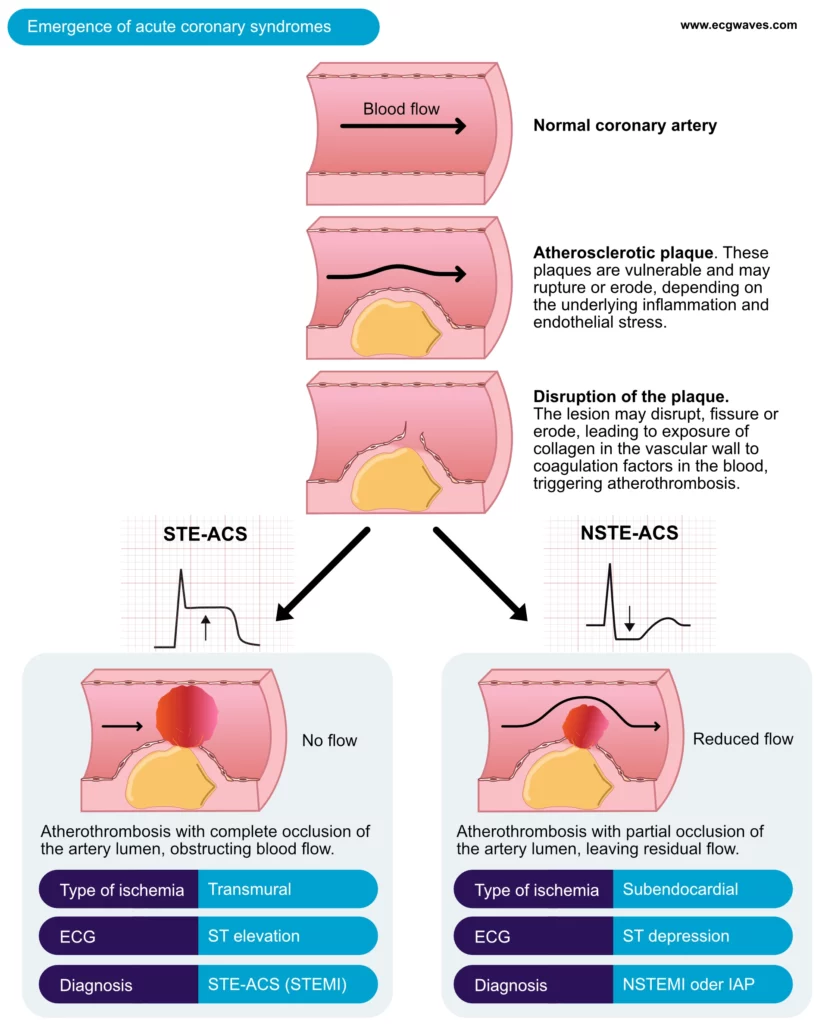
La classification opérationnelle immédiate repose sur l’ECG 12 dérivations, car c’est cet examen qui dicte la stratégie de reperfusion immédiate (fibrinolyse ou angioplastie primaire) :
- STE-ACS (STEMI) : Présence d’un sus-décalage persistant du segment ST (>20 min). Cela signe généralement une occlusion coronaire totale aiguë nécessitant une désobstruction immédiate.
- NSTE-ACS (NSTEMI et Angor Instable) : Absence de sus-décalage persistant du segment ST. L’ECG peut être normal, ou montrer un sous-décalage du segment ST, une inversion de l’onde T, ou une élévation transitoire du ST. La distinction ultérieure entre NSTEMI et Angor Instable se fait sur la base de la troponine :
- NSTEMI : Élévation des biomarqueurs (troponine) au-dessus du 99ème percentile, indiquant une nécrose cellulaire.
- Angor Instable : Ischémie myocardique au repos ou à l’effort minime, sans preuve biologique de nécrose myocardique.
Classification des Types d’Infarctus (Classification Universelle)
Il est également crucial de distinguer les mécanismes physiopathologiques selon la classification universelle de l’infarctus :
- Infarctus de Type 1 : Causé par une rupture, une ulcération, une fissure ou une érosion de plaque athérosclérotique entraînant un thrombus intraluminal. C’est le mécanisme classique du SCA spontané.
- Infarctus de Type 2 : Causé par un déséquilibre entre l’apport et la demande en oxygène du myocarde, sans rupture de plaque aiguë. Les causes incluent l’anémie sévère, la tachyarythmie, l’hypotension, le choc septique ou l’hypertension sévère. Le traitement cible ici la cause sous-jacente plutôt que la thrombose coronaire.
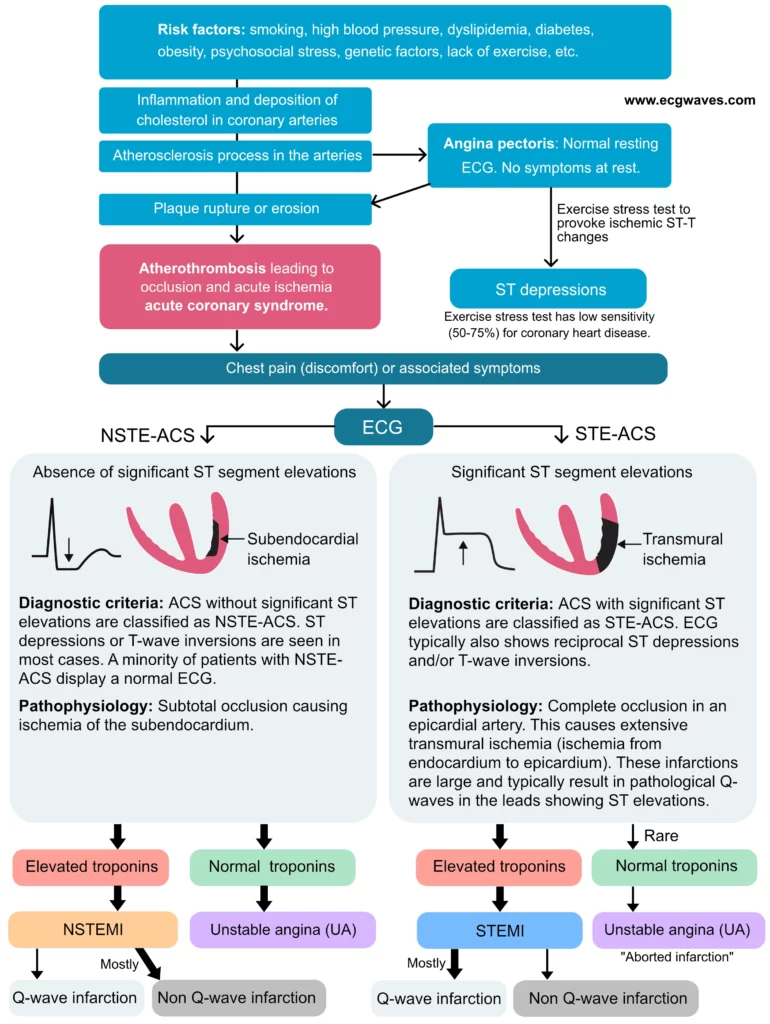
La figure 2 présente l’histoire naturelle et la classification des syndromes coronariens aigus.
MINOCA : Infarctus du Myocarde à Coronaires Non Obstruées
Il est important de mentionner une entité clinique particulière : le MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries). Environ 6 à 8 % des patients présentant un diagnostic de NSTEMI n’ont pas de sténose coronaire significative (>50 %) à l’angiographie. Les causes de MINOCA sont variées et nécessitent souvent une imagerie complémentaire (IRM cardiaque, OCT – tomographie par cohérence optique) pour être élucidées. Elles incluent :
- La rupture de plaque avec fibrinolyse spontanée du thrombus.
- Le spasme coronaire épicardique (Angor de Prinzmetal).
- La dysfonction microvasculaire.
- La dissection coronaire spontanée (SCAD), plus fréquente chez la femme jeune.
- La myocardite (qui mime un infarctus mais relève d’une étiologie inflammatoire).
- Le syndrome de Takotsubo (cardiomyopathie de stress).
Le diagnostic correct de l’étiologie sous-jacente au MINOCA est essentiel car le traitement diffère radicalement de celui de l’athérothrombose classique.
Épidémiologie de l’infarctus du myocarde sans sus-décalage du segment ST et de l’angor instable
La mortalité dans l’infarctus aigu du myocarde a diminué de 50 % au cours des trois dernières décennies. Cela s’explique par un recours accru à la revascularisation précoce (intervention coronarienne percutanée), par les progrès des anticoagulants et des antiplaquettaires puissants (inhibiteurs P2Y12), ainsi que par des stratégies agressives de prévention secondaire faisant appel aux statines à forte dose, aux inhibiteurs de l’enzyme de conversion et à la réadaptation cardiaque. La réduction du tabagisme dans certaines populations a aussi contribué aux tendances observées.
En 1990, les STEMI représentaient environ 50 % de tous les infarctus aigus du myocarde. L’incidence relative des STEMI a diminué progressivement depuis lors. Actuellement, le STEMI représente 25 à 40 % de tous les cas d’infarctus aigu du myocarde. Au cours de la même période, l’incidence du NSTEMI a augmenté proportionnellement pour atteindre 60-75 % de l’ensemble des infarctus. Ce phénomène de « shift » épidémiologique s’explique principalement par la généralisation de tests de biomarqueurs (troponine ultra-sensible). Ces tests permettent de détecter des nécroses minimes (micro-infarctus) qui échappaient aux tests de génération précédente (CK-MB ou troponines conventionnelles). Par conséquent, de nombreux patients qui auraient auparavant été diagnostiqués comme souffrant d’angor instable sont aujourd’hui correctement classés comme NSTEMI. La population des patients NSTEMI tend également à être plus âgée, avec plus de comorbidités (diabète, insuffisance rénale) que la population STEMI.
Physiopathologie : l’occlusion partielle et la vulnérabilité myocardique
La gravité des syndromes coronariens aigus dépend principalement de la localisation, de la taille et de la durée de l’occlusion, ainsi que de la présence d’une circulation collatérale. En ce qui concerne la localisation, les occlusions proximales (ex: artère interventriculaire antérieure proximale) sont plus graves que les occlusions distales, car elles mettent en péril une masse myocardique plus importante. Le STEMI est causé par des occlusions totales et persistantes ; de telles occlusions entraînent une ischémie/infarctus transmurale, s’étendant de l’endocarde à l’épicarde (onde de front de nécrose). Le NSTEMI et l’angor instable, en revanche, sont dus à des occlusions partielles ou transitoires, souvent liées à un thrombus labile qui se forme et se lyse par intermittence. De telles occlusions entraînent une ischémie/infarctus prédominant dans le territoire sous-endocardique. Le sous-endocarde est la zone la plus sensible à l’hypoperfusion car sa vascularisation dépend quasi exclusivement de la diastole et il subit la contrainte pariétale la plus forte. Reportez-vous aux figures 1, 2 et 3.
Complications aiguës et à long terme de l’infarctus du myocarde de type NSTEMI et de l’angor instable
Les complications aiguës du NSTEMI sont similaires à celles du STEMI, bien que l’insuffisance cardiaque aiguë massive et le choc cardiogénique soient moins fréquents à la présentation initiale. Cependant, le NSTEMI est souvent associé à une maladie coronarienne diffuse et pluritronculaire, ce qui peut assombrir le pronostic à long terme (récidives ischémiques plus fréquentes). Pour plus de détails, veuillez vous référer à la section Complications aiguës et à long terme de l’infarctus du myocarde avec sus-décalage du segment ST. La figure 4 résume les complications, incluant les troubles du rythme, la dysfonction ventriculaire gauche, et les complications mécaniques (rares dans le NSTEMI).

ECG dans l’infarctus du myocarde de type NSTEMI et l’angor instable
L’analyse de l’ECG est la pierre angulaire du triage initial. Le NSTEMI et l’angor instable provoquent généralement des dépressions du segment ST (sous-décalages), qui s’accompagnent fréquemment d’ondes T négatives (inversées) ou d’ondes T plates. Contrairement au STEMI, où le vecteur de l’élévation pointe vers la zone infarcie, les anomalies dans le NSTEMI sont plus diffuses. Il est important de noter que les dérivations qui présentent des dépressions du segment ST ne reflètent pas nécessairement avec précision la zone ischémique (« image en miroir » ou ischémie globale). Par exemple, des dépressions diffuses du segment ST (dans plus de 6 dérivations) associées à une élévation du segment ST en aVR sont évocatrices d’une atteinte du tronc commun ou d’une atteinte tritronculaire sévère, et non d’une ischémie localisée.
Les dépressions ST ischémiques sont caractérisées par un segment ST horizontal ou descendant. Les dépressions ascendantes sont souvent physiologiques (liées à la tachycardie). Les recommandations nord-américaines et européennes stipulent que le segment ST doit être soit descendant, soit horizontal, pour être considéré comme pathologique (figure 5). Une discussion approfondie sur les dépressions du segment ST est fournie dans le chapitre Dépressions du segment ST dans l’ischémie et l’infarctus.
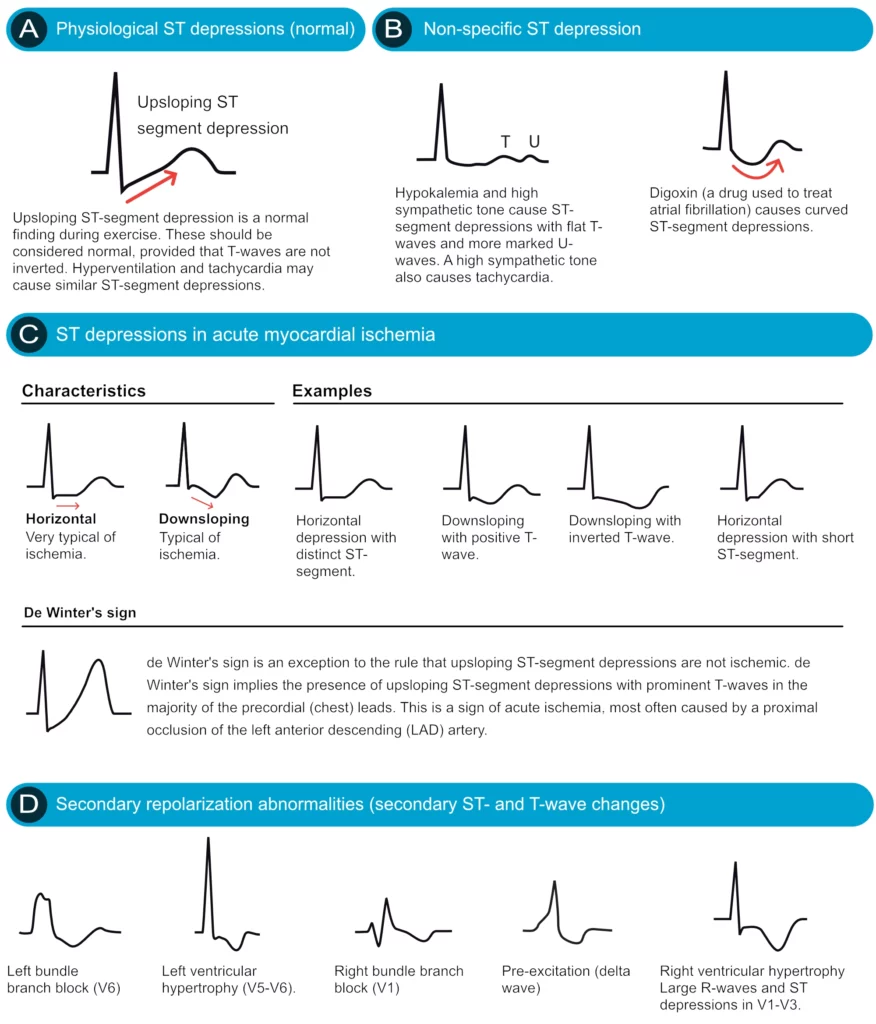

Critères ECG pour le diagnostic de NSTEMI et d’angor instable
Critères de dépression ischémique du segment ST
- Nouvelles dépressions horizontales ou descendantes du segment ST ≥0,5 mm dans au moins deux dérivations anatomiques contiguës.
- Un sous-décalage > 1 mm est fortement prédictif d’une ischémie sévère et d’un pronostic plus défavorable.
Critères d’inversion ischémique de l’onde T
- Inversion de l’onde T ≥ 1 mm dans au moins deux dérivations anatomiques contiguës. Ces dérivations doivent présenter des ondes R évidentes ou des ondes R plus grandes que les ondes S.
Modèles ECG à haut risque (Équivalents STEMI)
Certains tracés ECG, bien que techniquement classés comme NSTEMI (absence de sus-décalage ST classique), traduisent une occlusion artérielle critique imminente (souvent de l’IVA proximale) et doivent être traités avec la même urgence qu’un STEMI :
- Syndrome de Wellens : Ondes T biphasiques ou profondément inversées en V2-V3 pendant une période sans douleur. Cela signale une sténose critique de l’IVA proximale.
- Ondes T de De Winter : Dépression ascendante du segment ST au point J > 1mm en V1-V6, suivie d’ondes T hautes et symétriques. Ce signe est hautement spécifique d’une occlusion aiguë de l’IVA.
- Sus-décalage en aVR avec dépressions diffuses : Comme mentionné, cela suggère une atteinte du tronc commun ou tritronculaire.
Ondes Q pathologiques (infarctus)
Les ondes Q pathologiques sont historiquement associées aux infarctus transmuraux. Par conséquent, les patients atteints de NSTEMI ne développent généralement pas d’ondes Q pathologiques significatives, car la nécrose reste confinée au sous-endocarde. Cependant, dans certains cas évolués ou non traités, la lésion sous-endocardique peut s’étendre, ce qui peut entraîner des ondes Q pathologiques. Notez que l’angor instable n’entraîne aucune modification du QRS ni ondes Q, car il n’entraîne pas de nécrose myocardique.
ECG normal chez les patients atteints de NSTEMI ou d’angor instable
Une minorité significative de patients atteints de NSTE-ACS (10 à 25 %) présentent un ECG strictement normal ou non diagnostique à l’arrivée. C’est un piège diagnostique majeur. Il est toutefois rare que l’ECG reste normal tout au long de l’évolution de la maladie. La plupart des patients dont l’ECG est normal à l’arrivée présenteront des modifications dynamiques de l’ECG lors des épisodes douloureux. En outre, un ECG normal à l’arrivée n’exclut pas une ischémie myocardique dans le territoire de l’artère circonflexe (paroi latérale ou postérieure), souvent « silencieuse » à l’ECG standard 12 dérivations. C’est pourquoi l’enregistrement des dérivations postérieures (V7-V9) est recommandé en cas de forte suspicion clinique malgré un ECG standard normal.
Évaluation clinique et évaluation initiale des patients souffrant d’un NSTEMI et d’un angor instable
Prise en charge précoce et médicalisation
Les patients présentant une suspicion de NSTEMI ou d’angor instable doivent être immédiatement orientés vers le service des urgences, idéalement via les services médicaux d’urgence (SMU/SAMU). L’auto-transport est associé à des délais plus longs. Des études ont démontré plusieurs avantages liés à l’utilisation du SMU, tels que la possibilité de réaliser un ECG pré-hospitalier (permettant d’orienter directement vers une salle de cathétérisme si un STEMI est découvert) et l’instauration précoce des traitements. Pourtant, le SMU reste sous-utilisé.
L’équipe médicale doit immédiatement évaluer les fonctions vitales (ABCDE). Si le patient est stable sur le plan hémodynamique, il convient de procéder à une anamnèse ciblée sur les facteurs de risque cardiovasculaire et les caractéristiques de la douleur. Des thérapies fondées sur des données probantes (MONA : Morphine, Oxygène, Nitrates, Aspirine – bien que l’oxygène et la morphine soient aujourd’hui utilisés de manière plus restrictive) peuvent être initiées. Un défibrillateur doit toujours être prêt, car le risque de fibrillation ventriculaire primaire est maximal à la phase initiale. L’accès veineux périphérique est impératif.
ECG préhospitalier à 12 dérivations
Un ECG à 12 dérivations doit être réalisé dans les 10 minutes suivant le premier contact médical. Le personnel préhospitalier s’est avéré très capable de reconnaître les modifications ischémiques. Si l’ECG initial n’est pas diagnostique mais que la suspicion clinique est forte, des ECG supplémentaires doivent être répétés toutes les 15-30 minutes, ou en cas de récidive douloureuse.
Service des urgences : Triage et Biomarqueurs
Aux urgences, l’évaluation de la stabilité hémodynamique (recherche de signes de choc : hypotension, tachycardie, marbrures, oligurie) et respiratoire (signes d’OAP : crépitants, tachypnée) est prioritaire. Le diagnostic différentiel doit être évoqué systématiquement : dissection aortique (douleur déchirante, asymétrie tensionnelle), embolie pulmonaire (dyspnée prédominante, facteur de risque thromboembolique), pneumothorax.
Les Algorithmes de Troponine Ultra-Sensible (hs-cTn)
Le dosage de la troponine cardiaque (I ou T) est le pilier biologique du diagnostic. L’introduction des tests de troponine ultra-sensible (hs-cTn) a révolutionné la prise en charge en permettant des protocoles d’exclusion/inclusion rapides. Contrairement aux anciens protocoles nécessitant 6 à 12 heures, les lignes directrices actuelles de l’ESC recommandent l’utilisation d’algorithmes 0h/1h ou 0h/2h :
- Prélèvement à H0 : Si le taux est très bas, le NSTEMI peut être exclu (Rule-out) avec une haute valeur prédictive négative, permettant une sortie rapide si le score de risque est faible.
- Prélèvement à H1 ou H2 : Si l’élévation est significative ou si la variation (delta) entre H0 et H1 est importante, le diagnostic de NSTEMI est très probable (Rule-in), justifiant une hospitalisation et une échocardiographie.
- Zone grise (Observe) : Les patients qui ne remplissent ni les critères de rule-out ni de rule-in doivent rester en observation avec un nouveau dosage à H3.
Notez que des troponines élevées ne sont pas spécifiques de l’infarctus (type 1) ; elles indiquent une lésion myocardique qui peut être due à une insuffisance cardiaque, une embolie pulmonaire, une insuffisance rénale, ou une myocardite.
Preuve objective d’ischémie/infarctus du myocarde
Les patients présentant des signes objectifs d’ischémie (modifications ECG ou élévation des troponines) doivent être hospitalisés en USIC. Les patients sans preuve objective d’ischémie après le bilan initial (ECG et troponines sériées négatifs) et dont la douleur a cessé sont considérés à faible risque. Les lignes directrices recommandent pour ces patients un test d’ischémie non invasif (test d’effort, échocardiographie de stress, scintigraphie) ou, de plus en plus fréquemment, un coroscanner (CTCA) pour exclure une maladie coronaire anatomique avant la sortie.
Stratification du Risque : Scores TIMI et GRACE
La prise en charge doit être individualisée. Les patients à haut risque bénéficient d’une stratégie invasive précoce. Les lignes directrices recommandent formellement l’utilisation de scores de risque validés. Le score GRACE (Global Registry of Acute Coronary Events) est le plus performant pour prédire la mortalité hospitalière et à 6 mois. Un score GRACE > 140 indique un haut risque et justifie une coronarographie dans les 24h. Le score TIMI est plus simple à calculer au lit du malade mais moins discriminant.
Calculer le score de risque TIMI pour l’infarctus du myocarde avec sus-décalage du segment ST / l’angor instable
[calc_timi]
| SCORE TIMI | Mortalité à 30 jours | IM aigu à 30 jours | Probabilité de revascularisation |
|---|---|---|---|
| 0-1 | 1,2 % | 2,3 % | 1,2 % |
| 2 | 1,0 % | 2,1 % | 6,0 % |
| 3 | 1,7 % | 3,7 % | 9,5 % |
| 4 | 2,5 % | 5,0 % | 12,2 % |
| 5 | 5,6 % | 8,5 % | 14,3 % |
| 6-7 | 6,5 % | 15,8 % | 20,9 % |
Interprétation du score de risque TIMI.
Thérapies médicamenteuses fondées sur des données probantes
Oxygène : Une approche restrictive
L’oxygène n’est administré que si la saturation en oxygène est < 90 %. L’administration systématique d’oxygène aux patients normoxiques est potentiellement délétère (vasoconstriction coronaire, augmentation des radicaux libres).
Les études récentes (comme l’étude DETO2X-AMI) ont confirmé l’absence de bénéfice de l’oxygénothérapie de routine chez les patients avec une saturation normale. L’oxygène reste bien sûr indiqué en cas d’hypoxie, d’insuffisance cardiaque congestive ou de détresse respiratoire.
Analgésiques (Morphine)
Le sulfate de morphine peut être administré pour soulager une douleur thoracique sévère et persistante. Cependant, son utilisation est devenue plus prudente.
La douleur active le système nerveux sympathique, augmentant la postcharge et la demande en oxygène. La morphine est un analgésique puissant qui possède également des propriétés anxiolytiques et hémodynamiques favorables (veinodilatation réduisant la précharge, utile dans l’OAP). Toutefois, des données suggèrent que la morphine pourrait ralentir l’absorption intestinale des antiplaquettaires oraux (clopidogrel, ticagrélor, prasugrel), retardant ainsi leur action anti-thrombotique. Elle doit être réservée aux patients dont la douleur résiste aux dérivés nitrés.
Les AINS (anti-inflammatoires non stéroïdiens) sont strictement contre-indiqués en phase aiguë car ils augmentent le risque de rupture cardiaque et d’événements thrombotiques récurrents.
Nitrates (Dérivés nitrés)
Les nitrates sont le traitement de première ligne de l’angine de poitrine. Ils soulagent les symptômes par veinodilatation périphérique et vasodilatation coronaire.
La trinitrine sublinguale (spray ou comprimé) doit être administrée (0,4 mg toutes les 5 min, max 3 doses) en cas de douleur. Si la douleur persiste ou en cas d’hypertension/insuffisance cardiaque, une perfusion intraveineuse continue de nitroglycérine est indiquée. Les nitrates sont contre-indiqués si le patient a pris des inhibiteurs de la phosphodiestérase-5 (sildénafil, tadalafil) dans les 24-48h précédentes, en raison du risque d’hypotension réfractaire sévère.
Bêtabloquants
Les bêtabloquants oraux sont indiqués précocement (dans les 24h) chez les patients stables pour réduire la consommation myocardique d’oxygène et prévenir les arythmies.
Ils agissent en diminuant la fréquence cardiaque, la contractilité et la pression artérielle. Ils réduisent la mortalité à long terme. Cependant, l’administration intraveineuse aiguë n’est plus systématique et doit être évitée chez les patients à risque de choc cardiogénique (Killip > I, hypotension, bradycardie). Le métoprolol, le bisoprolol ou le carvédilol sont les molécules de choix.
Inhibiteurs calciques
Les inhibiteurs calciques bradycardisants (vérapamil, diltiazem) sont une alternative aux bêtabloquants en cas de contre-indication (ex: asthme sévère) ou d’ischémie persistante.
Ils sont particulièrement indiqués si une composante vasospastique est suspectée. Ils ne doivent pas être associés aux bêtabloquants (risque de bloc AV complet) ni utilisés en cas de dysfonction ventriculaire gauche sévère.
Traitement antithrombotique
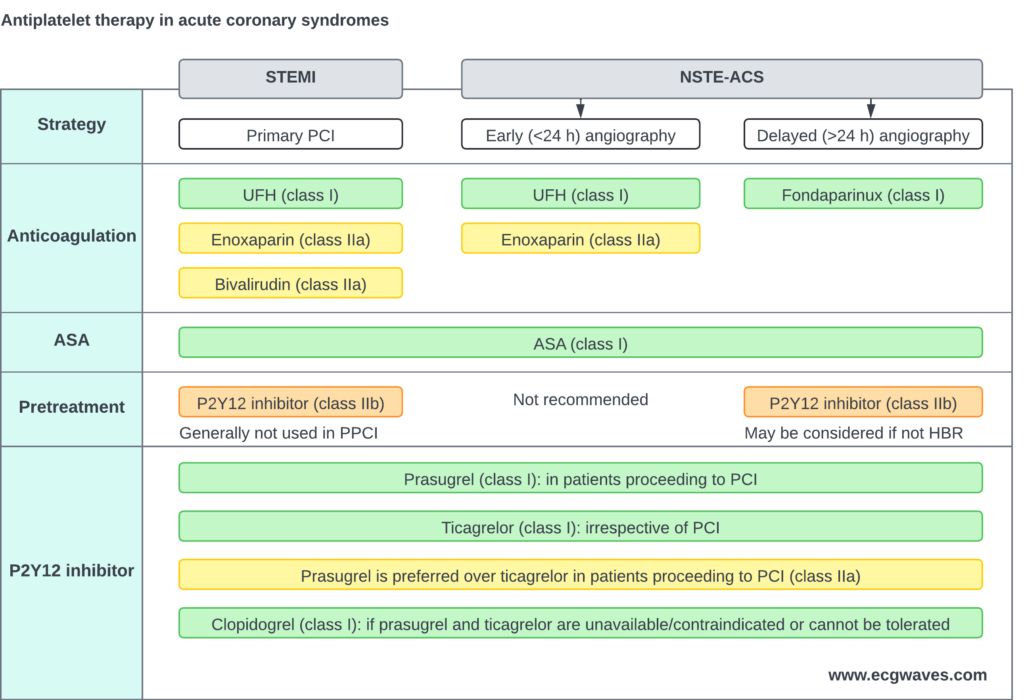
Double Antiagrégation Plaquettaire (DAPT)
L’inhibition plaquettaire est cruciale pour prévenir la croissance du thrombus blanc. Le standard de soin est l’association de l’aspirine et d’un inhibiteur puissant des récepteurs P2Y12.
L’aspirine (ASA)
Une dose de charge d’aspirine (150 mg à 300 mg per os ou IV) doit être administrée immédiatement à tous les patients naïfs. L’aspirine est ensuite poursuivie indéfiniment à une dose d’entretien faible (75-100 mg par jour) pour minimiser le risque hémorragique gastro-intestinal tout en maintenant l’efficacité anti-thrombotique.
Inhibiteurs des récepteurs P2Y12
Le choix de l’inhibiteur P2Y12 dépend du profil du patient et de la disponibilité du médicament. Les agents puissants (Ticagrélor, Prasugrel) sont préférés au Clopidogrel.
- Ticagrélor (Brilique) : Dose de charge de 180 mg, puis 90 mg deux fois par jour. C’est l’agent de choix pour la majorité des patients NSTEMI, quel que soit le plan de traitement initial (invasif ou non). Il réduit la mortalité par rapport au clopidogrel (étude PLATO).
- Prasugrel (Efient) : Dose de charge de 60 mg, puis 10 mg par jour. Il est très puissant mais réservé aux patients dont l’anatomie coronaire est connue et qui vont subir une angioplastie (PCI). Il ne doit pas être administré en « prétraitement » avant la coronarographie chez les patients NSTEMI, contrairement au STEMI. Il est contre-indiqué en cas d’antécédent d’AVC/AIT.
- Clopidogrel (Plavix) : Dose de charge de 300-600 mg, puis 75 mg/j. Il est réservé aux patients ayant une contre-indication aux nouveaux agents (risque hémorragique élevé, antécédent d’hémorragie intracrânienne) ou nécessitant une anticoagulation orale concomitante (fibrillation atriale).
Le débat du « Prétraitement » dans le NSTEMI
Les recommandations actuelles (ESC 2020) déconseillent l’administration systématique d’un inhibiteur P2Y12 avant de connaître l’anatomie coronaire (prétraitement) chez les patients NSTEMI prévus pour une stratégie invasive précoce (<24h). La raison est double : cela ne réduit pas les événements ischémiques pré-procéduraux mais augmente les saignements, et cela peut retarder une chirurgie de pontage (CABG) si elle s'avère nécessaire après l'angiographie. Le prétraitement par Ticagrélor peut être envisagé si l'angiographie est retardée.
Anticoagulants parentéraux
L’anticoagulation est obligatoire en phase aiguë pour inhiber la génération de thrombine.
Fondaparinux (Arixtra)
Le fondaparinux (2,5 mg sous-cutané une fois par jour) est l’anticoagulant de référence dans le NSTEMI en raison de son profil de sécurité supérieur (réduction majeure des saignements majeurs par rapport à l’énoxaparine dans l’étude OASIS-5) et d’une efficacité ischémique similaire. Si le patient subit une angioplastie, un bolus d’héparine non fractionnée (HNF) doit être ajouté pendant la procédure pour prévenir la thrombose de cathéter.
Enoxaparine et HNF
L’énoxaparine (HBPM) est une alternative valide si le fondaparinux n’est pas disponible. L’héparine non fractionnée (HNF) est généralement réservée aux patients qui vont au laboratoire de cathétérisme immédiatement.
Autres traitements essentiels : Statines et IEC
Statines de haute intensité
Une statine de haute intensité (ex: Atorvastatine 80 mg ou Rosuvastatine 20-40 mg) doit être initiée dès l’admission chez tous les patients NSTEMI, quel que soit le taux de cholestérol initial. L’objectif est double : réduire le LDL-cholestérol (< 0,55 g/L ou 1,4 mmol/L selon les cibles très haut risque ESC) et stabiliser la plaque grâce aux effets pléiotropes (anti-inflammatoires) des statines.
Inhibiteurs du SRAA (IEC / ARA II)
Les inhibiteurs de l’enzyme de conversion (IEC) ou les antagonistes des récepteurs de l’angiotensine II (ARA II) doivent être débutés dans les 24h chez les patients présentant une dysfonction ventriculaire gauche (FEVG ≤ 40%), une insuffisance cardiaque, du diabète ou un infarctus antérieur. Ils préviennent le remodelage ventriculaire délétère.
Stratégie Invasive et Revascularisation
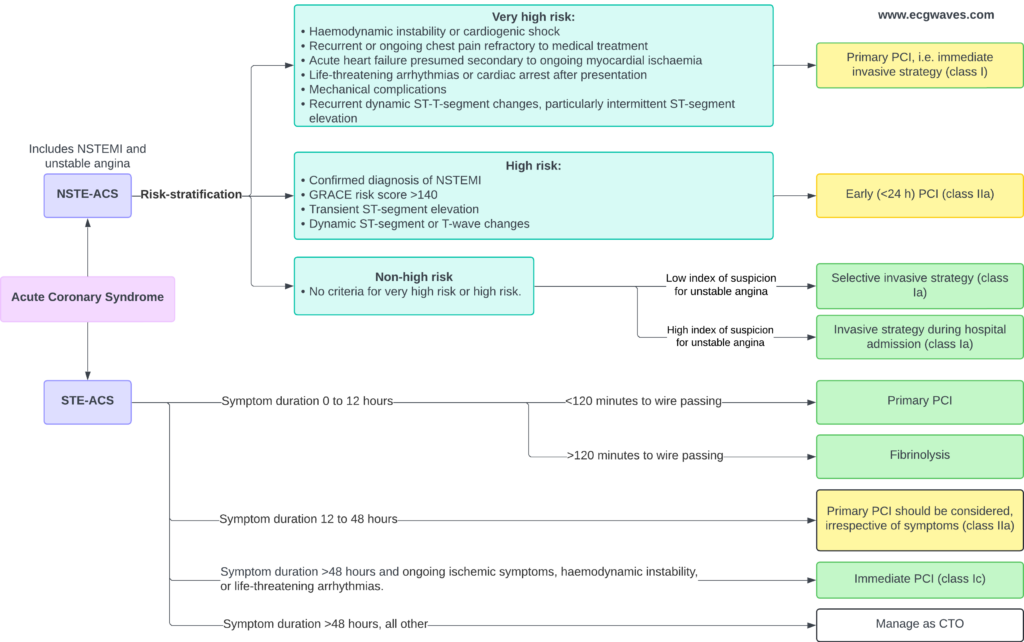
La coronarographie permet de définir l’anatomie lésionnelle et de guider la revascularisation. Contrairement au STEMI, la fibrinolyse intraveineuse n’a pas de place dans le NSTEMI (elle est même délétère).
Timing de l’Angiographie
- Une stratégie invasive IMMÉDIATE (< 2 heures), analogue au STEMI, est impérative pour les patients à « très haut risque » :
- Instabilité hémodynamique ou choc cardiogénique.
- Douleur thoracique récurrente ou réfractaire au traitement médical.
- Arythmies menaçant le pronostic vital ou arrêt cardiaque.
- Complications mécaniques de l’IM.
- Insuffisance cardiaque aiguë liée au NSTEMI.
- Modifications ST dynamiques récurrentes (notamment sus-décalage intermittent).
- Une stratégie invasive PRÉCOCE (< 24 heures) est recommandée pour les patients à « haut risque » :
- Diagnostic confirmé de NSTEMI (élévation des troponines).
- Modifications dynamiques du segment ST ou de l’onde T.
- Score de risque GRACE > 140.
- Une stratégie invasive SÉLECTIVE peut être envisagée pour les patients à « faible risque » (absence de récidive douloureuse, absence de signes d’insuffisance cardiaque, absence d’anomalies ECG, troponines négatives). Ces patients peuvent bénéficier d’un test d’ischémie non invasif avant d’envisager une coronarographie.
Le mode de revascularisation (ICP avec pose de stent ou chirurgie de pontage aorto-coronarien – PAC) dépend de la complexité des lésions (Score SYNTAX), de la présence d’un diabète et de la fonction ventriculaire gauche.
Références
2014 AHA/ACC Guideline for the Management of Patients With Non-ST-Elevation Acute Coronary Syndromes
Fourth Universal Definition of Myocardial Infarction (2018)
Collet JP et al. 2020 ESC Guidelines management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021.