Fondements de l’électrophysiologie et de l’électrocardiographie cardiaque
Principes de l’électrophysiologie cardiaque et de l’électrocardiographie (ECG)
- Types cellulaires en électrocardiologie
- Architecture des cellules myocardiques et syncytium fonctionnel
- Le potentiel d’action cardiaque
- Stimulateurs cardiaques secondaires et hiérarchie
- Aspects cliniques de l’automaticité cardiaque
- Le système de conduction auriculo‑ventriculaire
- Bases physiques de l’enregistrement ECG : Le concept de vecteur
- Définition du rythme cardiaque
- Conclusion
Pour assurer une fonction de pompage cardiaque optimale et un débit cardiaque adapté aux besoins métaboliques de l’organisme, les oreillettes et les ventricules doivent être activés de manière rapide, séquentielle et coordonnée. L’activation rapide permet de recruter simultanément la plus grande masse myocardique possible ; plus la contraction des fibres myocardiques est synchronisée, plus l’efficacité hémodynamique est élevée. L’activation séquentielle implique que les oreillettes se contractent en premier, assurant ainsi un remplissage ventriculaire actif (contribution atriale) avant le déclenchement de la systole ventriculaire. La coordination de ces deux processus repose sur l’intégrité du système de conduction cardiaque, constitué de cellules myocardiques hautement spécialisées.
Organisées en faisceaux de fibres et en nœuds, ces cellules fonctionnent comme des câbles électriques biologiques, transmettant le potentiel d’action de manière rapide et ordonnée vers le myocarde contractile des oreillettes, puis des ventricules. Lorsque le myocarde contractile reçoit le potentiel d’action, il se dépolarise et se contracte par le mécanisme de couplage excitation-contraction. La figure 1 illustre les principaux composants du système de conduction, leur disposition anatomique et les tracés électrocardiographiques de surface qui leur sont temporellement associés.

Types cellulaires en électrocardiologie
Sur le plan électrophysiologique et histologique, il convient de distinguer deux grandes catégories de cellules myocardiques, chacune possédant des propriétés membranaires distinctes :
- Les cellules du tissu de conduction (cellules automatiques ou nodales) : Elles constituent un réseau spécialisé de fibres (tissu nodal et réseau de His-Purkinje) intégrées au myocarde. Leur fonction première est la genèse (automaticité) et la transmission rapide et synchronisée du potentiel d’action. Elles contiennent peu de myofibrilles contractiles et ne participent pas de manière significative à la force mécanique du cœur.
- Les cellules contractiles du myocarde (cardiomyocytes de travail) : Elles constituent la majeure partie de la masse cardiaque et assurent la contraction mécanique (inotropisme). Bien que leur fonction principale soit mécanique, elles possèdent également la capacité de propager le potentiel d’action via les jonctions communicantes, bien que cette conduction soit nettement plus lente que celle réalisée par les cellules spécialisées. Les termes « myocarde contractile », « myocarde » ou, plus simplement, « cellule myocardique » désignent ce type cellulaire.
Architecture des cellules myocardiques et syncytium fonctionnel
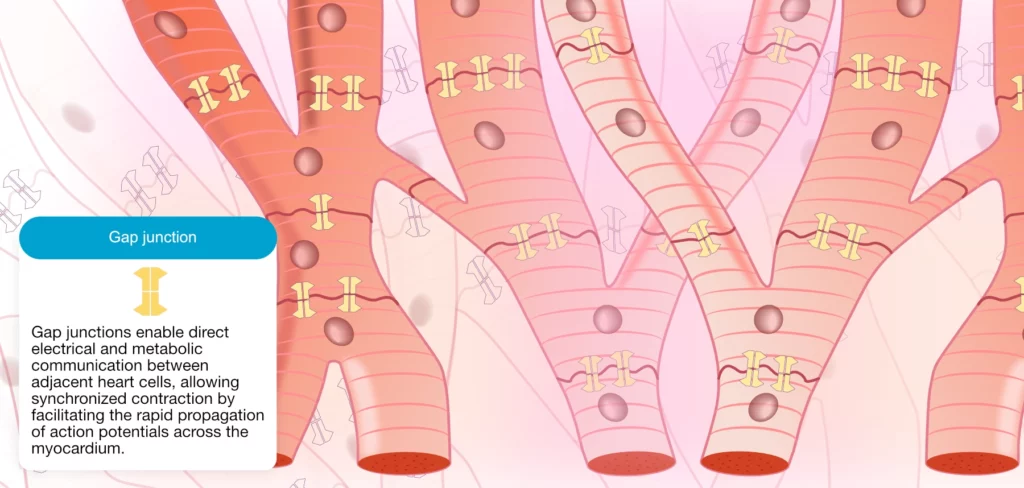
Contrairement aux fibres musculaires squelettiques qui sont isolées les unes des autres, les cardiomyocytes présentent une morphologie ramifiée et sont étroitement connectés. Comme l’illustre la figure 2, l’ensemble des cellules myocardiques est interconnecté, à la fois électriquement et mécaniquement, le long de leur grand axe. Cette organisation cellulaire forme un syncytium fonctionnel, au sein duquel le réseau de cardiomyocytes agit comme une unité intégrée. Ainsi, l’activation d’un cardiomyocyte entraîne, pour autant que les cellules soient excitables, la dépolarisation séquentielle de toutes les cellules situées en aval (« loi du tout ou rien »).
Les zones de jonction entre cardiomyocytes, appelées disques intercalaires, sont constituées de complexes protéiques membranaires assurant simultanément la cohésion mécanique (desmosomes) et la continuité électrique entre cellules adjacentes. La conduction électrique est spécifiquement assurée par les jonctions communicantes (gap junctions). Ces structures sont formées de canaux protéiques transmembranaires, les connexons (composés de connexines, notamment la Cx43 dans le ventricule et la Cx40/Cx45 dans le tissu conducteur), permettant le passage direct d’ions chargés d’une cellule à l’autre. Ce couplage électrotonique à faible résistance garantit la propagation rapide et coordonnée du potentiel d’action.
Il est important de noter le concept d’anisotropie : la vitesse de conduction est plus rapide dans le sens longitudinal de la fibre (axe des jonctions communicantes) que dans le sens transversal. Une altération de ces jonctions (fibrose, ischémie) peut ralentir la conduction et favoriser les arythmies par réentrée.
Le potentiel d’action cardiaque
Le potentiel d’action cardiaque est la manifestation électrique fondamentale de l’activité cellulaire. Il se compose d’une phase de dépolarisation (activation) suivie d’une phase de repolarisation (récupération). Le cycle cardiaque débute physiologiquement lorsque le nœud sinusal génère un premier potentiel d’action, qui se propage à travers le myocarde tel un front d’onde se diffusant dans un milieu conducteur.
Au cours de ces phases, des canaux ioniques voltage-dépendants spécifiques de la membrane plasmique s’ouvrent et se ferment de manière séquentielle, permettant le passage des ions sodium (Na⁺), potassium (K⁺) et calcium (Ca²⁺) selon leurs gradients électrochimiques. Ce flux ionique est à l’origine des courants transmembranaires qui modifient le voltage cellulaire. La figure 3 illustre la genèse du potentiel d’action dans les cardiomyocytes contractiles (potentiel d’action à réponse rapide), caractérisé par un plateau calcique soutenu.
Notion de Périodes Réfractaires
Une caractéristique cruciale des cellules cardiaques est l’existence d’une période réfractaire. Immédiatement après la dépolarisation, la cellule devient inexcitable : c’est la période réfractaire absolue. Aucun stimulus, quelle que soit son intensité, ne peut engendrer un nouveau potentiel d’action durant cette phase. Elle est suivie par la période réfractaire relative, durant laquelle un stimulus supraliminaire peut déclencher un potentiel d’action, souvent de moindre amplitude et de conduction plus lente. Ce mécanisme protège le cœur contre une tétanisation (contraction soutenue fatale) et organise la direction de la propagation de l’influx.
Les termes « impulsion électrique », « impulsion », « front d’activation » et « onde d’impulsion » sont employés de manière interchangeable pour désigner la propagation du potentiel d’action à travers le myocarde.

Couplage électromécanique du cœur
La dépolarisation des cellules myocardiques déclenche une cascade de processus intracellulaires conduisant à leur contraction. C’est le phénomène de couplage excitation-contraction. L’entrée de calcium dans la cellule durant la phase de plateau du potentiel d’action provoque la libération massive de calcium stocké dans le réticulum sarcoplasmique (phénomène de Calcium-Induced Calcium Release). Ce calcium se lie à la troponine C, permettant l’interaction actine-myosine et le raccourcissement de la fibre.
Les tissus et les liquides environnant le cœur – et, plus largement, l’ensemble de l’organisme – riches en électrolytes, se comportent comme un conducteur de volume. Ils permettent la propagation des champs électriques générés par l’activité cardiaque jusqu’à la surface cutanée. L’électrocardiographie consiste à enregistrer la différence de potentiel entre deux points à la surface du corps. L’électrocardiographe convertit ces signaux en un tracé graphique appelé électrocardiogramme (ECG).
Il est fondamental de noter que les potentiels électriques générés par les structures du système de conduction cardiaque — nœud sinusal, nœud auriculo‑ventriculaire, faisceau de His — présentent une masse trop faible pour générer un vecteur détectable par des électrodes de surface. Par conséquent, l’ECG standard 12 dérivations enregistre uniquement l’activité électrique du myocarde contractile auriculaire (onde P) et ventriculaire (complexe QRS et onde T). L’activité du système de conduction est « silencieuse » sur l’ECG de surface mais est déduite de l’analyse des intervalles (ex: intervalle PR). Pour l’analyse directe de ces potentiels (ex: potentiel hisien), des explorations électrophysiologiques endocavitaires invasives sont nécessaires.
Le système de conduction électrique cardiaque est constitué d’un réseau spécialisé de cellules myocardiques responsables de la génération et de la propagation des impulsions électriques, assurant ainsi une synchronisation spatio-temporelle optimale entre la contraction auriculaire et la contraction ventriculaire.
Le nœud sinusal, également appelé nœud sino-auriculaire (nœud SA), constitue le principal centre d’automatisme cardiaque et initie l’influx électrique responsable de la dépolarisation auriculaire.
Le nœud sinusal est une structure en forme de croissant, de 10 à 20 mm de long, située à la jonction de la veine cave supérieure et de l’oreillette droite (figure 1). Vascularisé majoritairement par l’artère coronaire droite (60% des cas) ou circonflexe (40% des cas), il est constitué de cellules pacemakers (« cellules P ») entourées de cellules transitionnelles. Ces cellules se caractérisent par une instabilité de leur potentiel de repos : elles se dépolarisent spontanément en phase diastolique (phase 4) jusqu’à atteindre un potentiel seuil. Cette propriété est désignée sous le terme d’« automaticité ».
Le rythme intrinsèque de dépolarisation du nœud sinusal est le plus rapide du cœur, environ 60 à 100 impulsions par minute chez l’adulte au repos. En imposant sa fréquence, il supprime l’automatisme des foyers sous-jacents plus lents (mécanisme d’overdrive suppression), ce qui en fait le stimulateur cardiaque (« pacemaker ») physiologique primaire.
La pente de dépolarisation diastolique spontanée du nœud sinusal est finement modulée par le système nerveux autonome. La stimulation sympathique (noradrénaline, récepteurs bêta-1) augmente la pente de dépolarisation, accélérant la fréquence cardiaque (effet chronotrope positif). À l’inverse, la stimulation parasympathique (acétylcholine, nerf vague) hyperpolarise la cellule et réduit la pente, ralentissant le cœur (effet chronotrope négatif). La fréquence cardiaque de repos reflète la prédominance du tonus vagal (freinateur) sur le tonus sympathique.
Stimulateurs cardiaques secondaires et hiérarchie
Bien que le nœud sinusal soit le stimulateur dominant, d’autres structures du système de conduction possèdent la capacité de dépolarisation diastolique spontanée. En conditions physiologiques, cette automaticité est latente, inhibée par la fréquence plus élevée du nœud sinusal (suppression par stimulation rapide ou overdrive suppression). Ces foyers de substitution ou « échappements » peuvent prendre le relais en cas de défaillance sinusale ou de bloc de conduction.
- Foyers auriculaires : Certaines régions du myocarde auriculaire (crista terminalis, ostium du sinus coronaire, pourtour des veines pulmonaires) contiennent des cellules dotées d’automatisme. Elles peuvent générer des rythmes d’échappement auriculaire (env. 55-60 bpm).
- La jonction auriculo-ventriculaire : Le myocarde périnodal et la portion distale du nœud AV (région N-H) possèdent une capacité d’automatisme. En cas de défaillance sinusale, un rythme d’échappement jonctionnel (40-60 bpm) à complexes QRS fins émerge généralement.
- Le réseau de His-Purkinje : Le faisceau de His et les fibres de Purkinje constituent l’ultime recours. Leur fréquence intrinsèque est très lente (20-40 bpm) et peu fiable. Un rythme d’échappement idioventriculaire se caractérise par des complexes QRS larges, traduisant une conduction ventriculaire ralentie cellule à cellule.
Le myocarde contractile ventriculaire proprement dit ne présente pas, en conditions physiologiques, d’automaticité intrinsèque. L’apparition d’une activité automatique à ce niveau est toujours pathologique (ischémie, désordres électrolytiques).
La hiérarchie des stimulateurs (Figure 4) assure une sécurité redondante : si le « capitaine » (nœud sinusal) flanche, les « lieutenants » prennent le commandement, bien que moins efficacement.
Aspects cliniques de l’automaticité cardiaque
Le dysfonctionnement du nœud sinusal (maladie du sinus) peut se manifester par une bradycardie sinusale sévère, des pauses sinusales ou un bloc sino-auriculaire. L’absence d’activité sinusale lève l’inhibition (overdrive suppression) exercée sur les centres inférieurs, permettant l’émergence d’un rythme d’échappement. La tolérance clinique de ce rythme dépend de sa fréquence et de la séquence d’activation (la perte de synchronisme auriculo-ventriculaire peut entraîner une hypotension).
À l’inverse, une automaticité pathologique (exaltée) peut survenir dans des foyers ectopiques, dépassant la fréquence sinusale et prenant le contrôle du rythme cardiaque, entraînant des tachycardies (ex: tachycardie atriale, tachycardie ventriculaire).

Transmission des impulsions : mécanismes de conduction et de propagation
La propagation de l’onde d’activation dépend de l’excitabilité des cellules et de la qualité du couplage intercellulaire (gap junctions). La vitesse de conduction varie considérablement selon les régions cardiaques, adaptée à la fonction de chaque segment.
Transmission de l’influx électrique au sein des oreillettes
Depuis le nœud sinusal, l’onde de dépolarisation se propage de manière radiaire dans le myocarde de l’oreillette droite. Bien que l’existence de voies anatomiques isolées (« tractus internodaux ») soit débattue histologiquement, il existe fonctionnellement des voies de conduction préférentielle (antérieure, moyenne, postérieure) facilitant l’arrivée rapide de l’influx au nœud AV. La transmission vers l’oreillette gauche est assurée principalement par le faisceau de Bachmann, une large bande de fibres myocardiques reliant les deux oreillettes. Une altération de ce faisceau peut désynchroniser les oreillettes et favoriser la fibrillation atriale. La vitesse de conduction auriculaire moyenne est d’environ 0,8 à 1 m/s.
Le système de conduction auriculo‑ventriculaire
Le nœud auriculo-ventriculaire (nœud AV) est une structure complexe assurant le filtrage et le ralentissement de l’influx électrique des oreillettes vers les ventricules.
Situé à la base de l’oreillette droite, dans le triangle de Koch, le nœud AV possède deux propriétés électrophysiologiques fondamentales :
- La conduction décrémentielle : Plus la fréquence de stimulation auriculaire est rapide, plus la conduction dans le nœud AV ralentit. C’est une propriété protectrice majeure qui limite le nombre d’impulsions transmises aux ventricules en cas de tachyarythmie auriculaire (ex: fibrillation auriculaire), évitant ainsi une réponse ventriculaire excessivement rapide.
- Le délai physiologique : La conduction y est très lente (0,05 m/s) en raison de potentiels d’action calciques à montée lente et de la faible densité de gap junctions. Ce délai (visible sur l’intervalle PR de l’ECG) permet la systole atriale complète et le remplissage ventriculaire optimal avant la contraction ventriculaire.
Physiologie de la double voie nodale : Chez la majorité des individus, l’approche du nœud AV s’effectue par deux voies fonctionnelles distinctes : une voie rapide (conduction rapide, période réfractaire longue) et une voie lente (conduction lente, période réfractaire courte). Cette dualité est le substrat anatomique des tachycardies par réentrée intranodale (TRIN), l’arythmie paroxystique la plus fréquente.
Le faisceau de His et les branches
Le faisceau de His prolonge le nœud AV et traverse le corps fibreux central, seule connexion électrique normale entre oreillettes et ventricules. Il se divise rapidement en :
- Branche droite : Fine et longue, elle chemine le long du septum interventriculaire jusqu’à la pointe du ventricule droit.
- Branche gauche : Plus large, elle se divise précocement en un hémifascicule antérieur (fin, vulnérable) et un hémifascicule postérieur (large, robuste, à double vascularisation).
Cette anatomie explique les différents types de blocs de branche et d’hémiblocs rencontrés en clinique.
Les fibres de Purkinje
Les branches se ramifient en un vaste réseau sous-endocardique, les fibres de Purkinje. Ces cellules de grand diamètre conduisent l’influx à très haute vitesse (jusqu’à 4 m/s), permettant une activation quasi-instantanée et synchrone de la masse ventriculaire. L’activation débute au niveau du septum (de gauche à droite), puis de l’apex vers les bases, et de l’endocarde vers l’épicarde (Figure 5). Cette séquence garantit une éjection ventriculaire efficace.

Influences du système nerveux autonome
Le système nerveux autonome régule l’ensemble des propriétés cardiaques :
- Système Parasympathique (Vagal) : Via le neurotransmetteur acétylcholine, il agit principalement sur les nœuds sinusal et AV. Il est bradycardisant (chronotrope négatif) et ralentit la conduction nodale (dromotrope négatif), allongeant l’intervalle PR. Une hypertonie vagale peut provoquer des blocs AV transitoires ou des pauses sinusales (syncope vaso-vagale).
- Système Sympathique : Via la noradrénaline, il innerve tout le cœur. Il augmente la fréquence cardiaque, la vitesse de conduction (réduction de l’intervalle PR et de la durée du QRS), la contractilité (inotrope positif) et la vitesse de relaxation (lusitrope positif). Cependant, il augmente également l’excitabilité (batmotrope positif), favorisant les arythmies.
Bases physiques de l’enregistrement ECG : Le concept de vecteur
Pour comprendre l’ECG, il faut saisir que l’activité électrique d’une cellule isolée est trop faible pour être détectée à distance. L’ECG enregistre la sommation spatiale et temporelle des potentiels d’action de millions de cellules.
Lorsqu’un front de dépolarisation avance dans le myocarde, il crée un dipôle électrique avec une charge positive en avant (vers le tissu au repos) et une charge négative en arrière (vers le tissu dépolarisé). Ce dipôle génère un vecteur électrique moyen qui possède une magnitude, une direction et un sens. La règle fondamentale de l’ECG est la suivante :
- Si le vecteur de dépolarisation se dirige vers l’électrode exploratrice positive, l’ECG inscrit une déflexion positive (au-dessus de la ligne isoélectrique).
- Si le vecteur s’éloigne de l’électrode, l’ECG inscrit une déflexion négative.
- Si le vecteur est perpendiculaire à l’axe de l’électrode, la déflexion est biphasique ou nulle.
L’ECG 12 dérivations offre ainsi 12 angles de vue différents de ce même vecteur cardiaque tridimensionnel.
Définition du rythme cardiaque
L’analyse du rythme est la première étape de l’interprétation d’un ECG. Un rythme cardiaque se définit comme une succession d’au moins trois complexes consécutifs d’origine commune.
- Rythme Sinusal : C’est le rythme physiologique normal. Il est caractérisé par une onde P positive en dérivation II (indiquant un vecteur atrial dirigé vers le bas et la gauche) précédant chaque complexe QRS, avec un intervalle PR constant.
- Rythme Ectopique : Tout rythme dont l’origine n’est pas le nœud sinusal. Si le foyer est supra-ventriculaire, les QRS sont généralement fins. Si le foyer est ventriculaire, les QRS sont larges.
- Rythme d’échappement : Rythme ectopique lent prenant le relais suite à une défaillance du pacemaker dominant (mécanisme de sécurité passif).
- Extrasystole : Dépolarisation prématurée provenant d’un foyer ectopique (mécanisme actif d’excitabilité anormale).
Conclusion
Le cycle cardiaque repose sur une séquence électrique immuable : genèse de l’impulsion dans le nœud sinusal, conduction atriale, délai nodal AV, conduction rapide His-Purkinje et activation ventriculaire synchronisée. Ce processus, régi par les propriétés membranaires des canaux ioniques et l’architecture en syncytium, garantit l’efficacité hémodynamique.
L’électrocardiogramme (ECG) est la traduction vectorielle de surface de ces phénomènes ioniques. Sa compréhension nécessite une maîtrise des principes électrophysiologiques sous-jacents, permettant au clinicien de diagnostiquer avec précision les troubles du rythme et de la conduction.
Les lecteurs intéressés peuvent se référer au diagramme de Wiggers ci-dessous, qui synthétise de manière précise la corrélation temporelle entre les phénomènes électriques (ECG), mécaniques (pressions, volumes) et acoustiques (bruits du cœur) au cours du cycle cardiaque.
