Fibrillation ventriculaire, activité électrique sans pouls et arrêt cardiaque soudain
Fibrillation ventriculaire, activité électrique sans pouls (AESP) et arrêt cardiaque soudain
Ce chapitre traite de la fibrillation ventriculaire (FV) et de l’activité électrique sans pouls (AESP), deux mécanismes d’arrêt circulatoire nécessitant une prise en charge immédiate pour prévenir le décès. La fibrillation ventriculaire résulte de la fragmentation des fronts d’onde électriques en multiples circuits de réentrée (mécanismes de wavelets ou rotors), induisant une activité électrique ventriculaire anarchique, très rapide (> 300 bpm) et inefficace. Sur le plan hémodynamique, cette désorganisation empêche toute éjection systolique, entraînant un collapsus immédiat, une perte de conscience et un arrêt cardiaque soudain (ACS). Contrairement à certaines tachycardies ventriculaires, la FV ne se résout pratiquement jamais spontanément chez l’homme adulte et évolue inéluctablement vers l’asystolie et le décès en l’absence de défibrillation externe.
Environ 75 à 80 % des patients victimes d’un arrêt cardiaque soudain présentent une fibrillation ventriculaire ou une tachycardie ventriculaire sans pouls lors de l’analyse initiale du rythme. L’étiologie prédominante reste la cardiopathie ischémique (maladie coronarienne), souvent dans le contexte d’un syndrome coronarien aigu ou d’une cicatrice d’infarctus ancien. Parmi les autres causes, on retrouve les cardiomyopathies (hypertrophique, dilatée), la dysplasie/cardiomyopathie arythmogène du ventricule droit (DAVD), et les canalopathies héréditaires telles que le syndrome de Brugada, le syndrome du QT long congénital et le syndrome de repolarisation précoce malin. Des facteurs précipitants aigus comme les troubles électrolytiques sévères (hypokaliémie, hypomagnésémie), l’acidose, l’hypoxémie et l’effet pro-arythmique de certains médicaments peuvent déclencher une FV, même sur un cœur structurellement sain.
Caractéristiques électrocardiographiques de la fibrillation ventriculaire
L’ECG diagnostique une activité électrique ventriculaire totalement chaotique. Elle se caractérise par des ondulations continues, irrégulières en fréquence (généralement > 300/min), en forme et en amplitude. Aucun complexe QRS, segment ST, onde P ou onde T n’est identifiable. L’aspect est pathognomonique.
On distingue classiquement deux phases électrocardiographiques :
- La fibrillation ventriculaire « à grosses mailles » (coarse VF) : Elle survient précocement après l’arrêt cardiaque. L’amplitude des ondes est élevée (> 0,2 mV). C’est un signe de réserve énergétique myocardique encore préservée et un facteur prédictif favorable de succès de la défibrillation.
- La fibrillation ventriculaire « à fines mailles » (fine VF) : Avec la prolongation de l’arrêt cardiaque et l’épuisement des réserves en ATP, l’amplitude des ondes diminue progressivement. Une FV à fines mailles (amplitude < 0,2 mV) est souvent plus difficile à réduire par choc électrique et peut être confondue avec une asystolie.

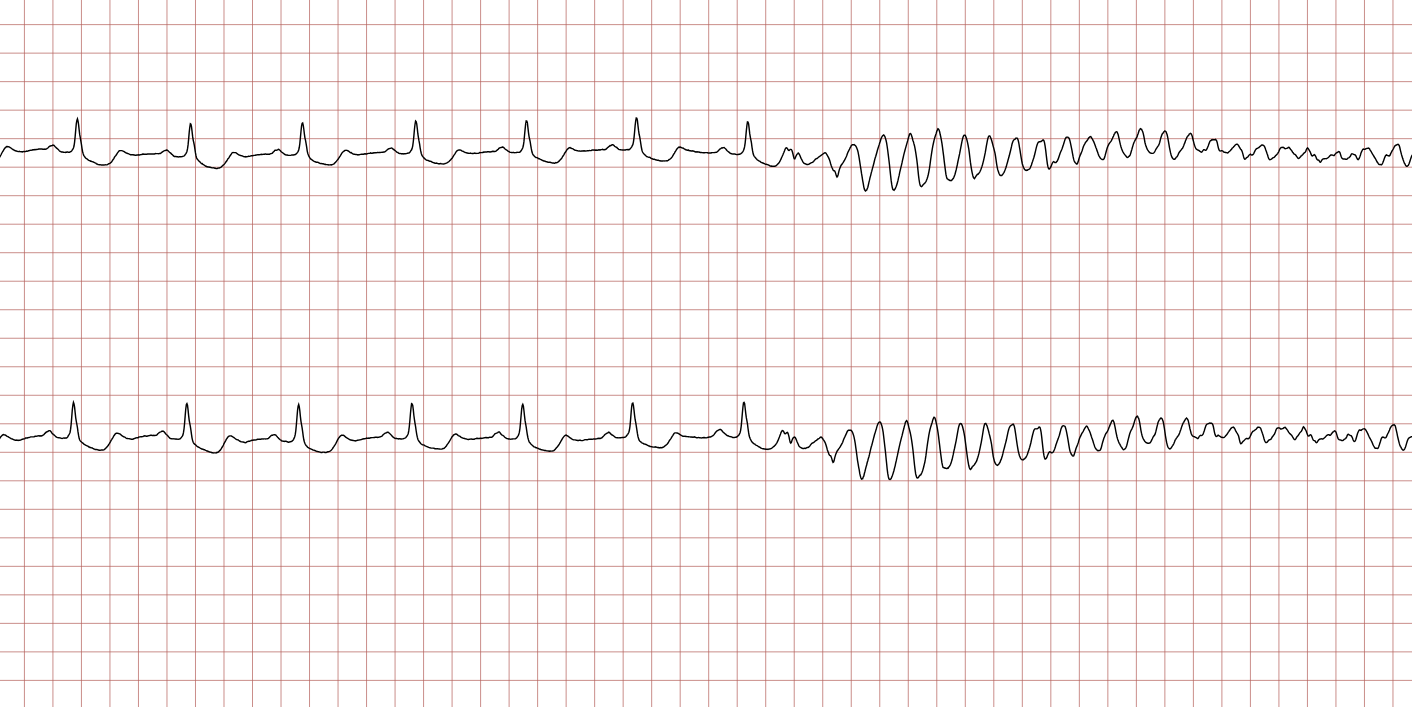
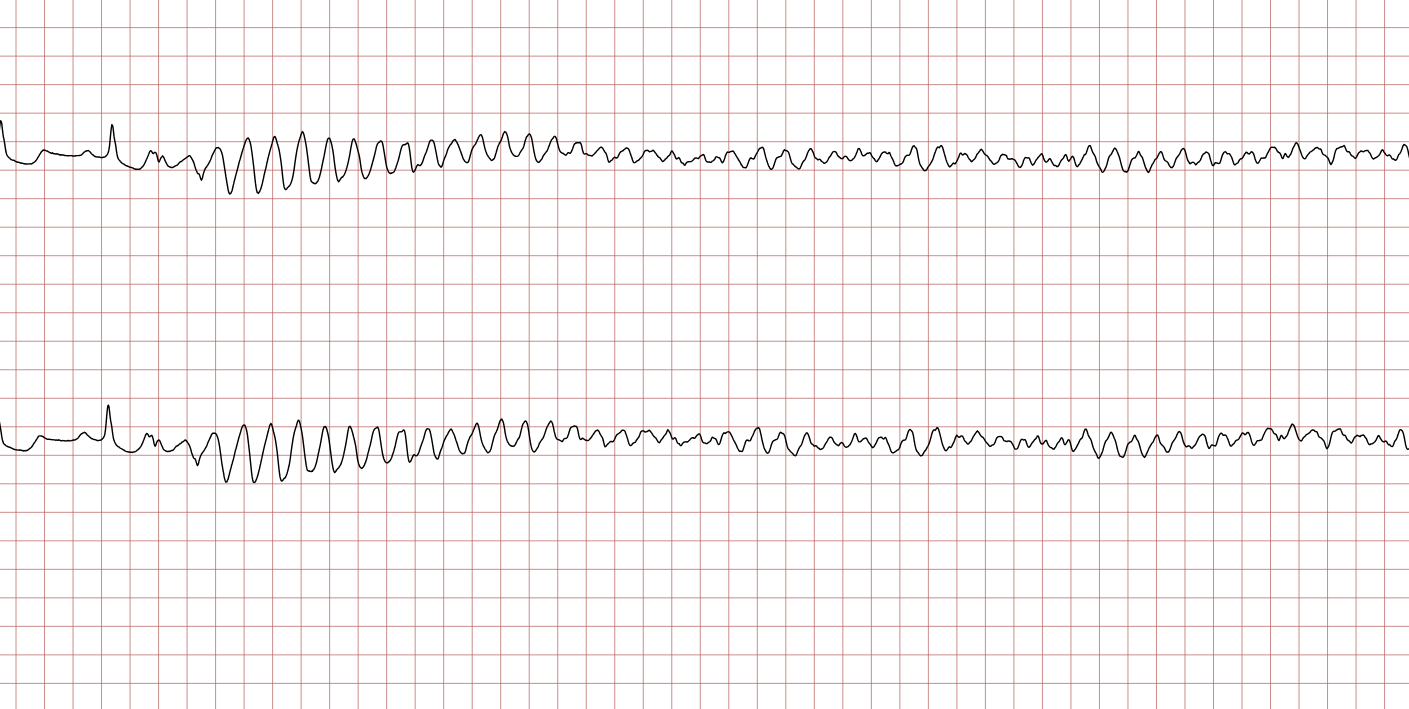
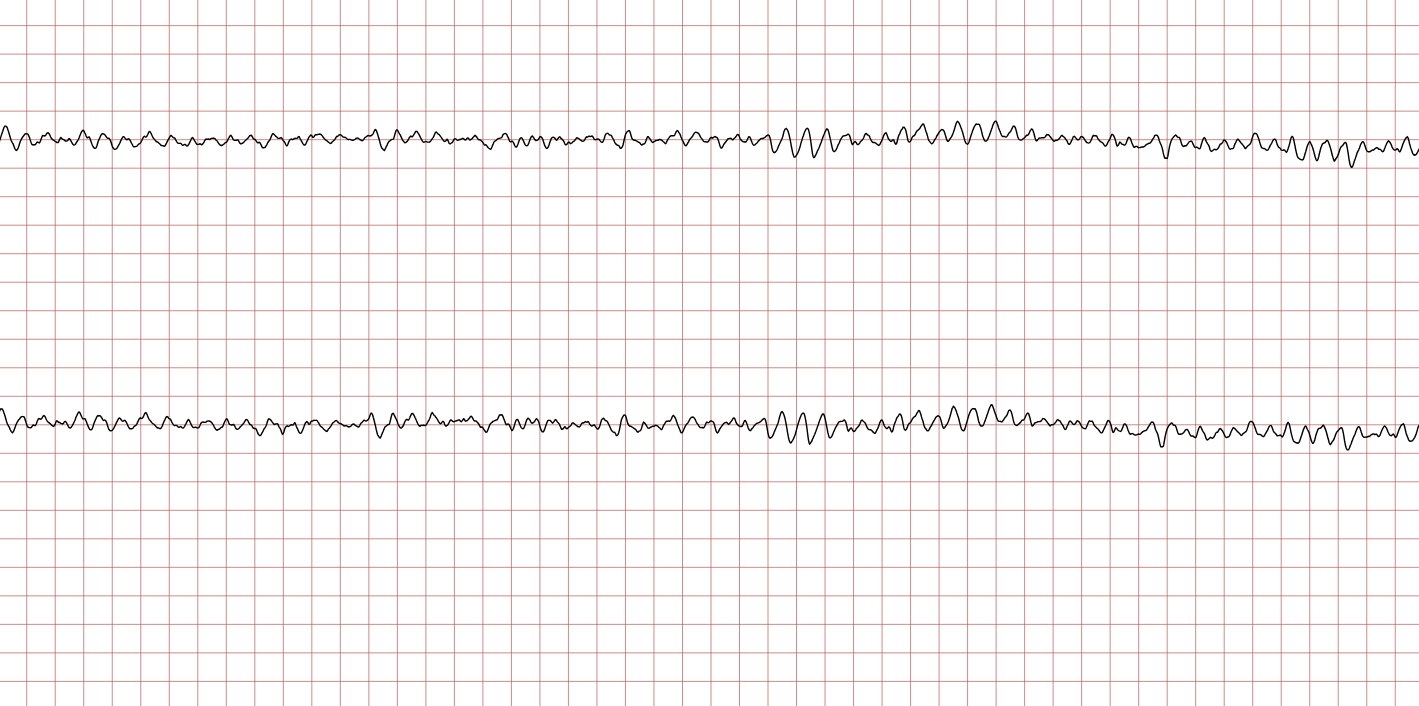
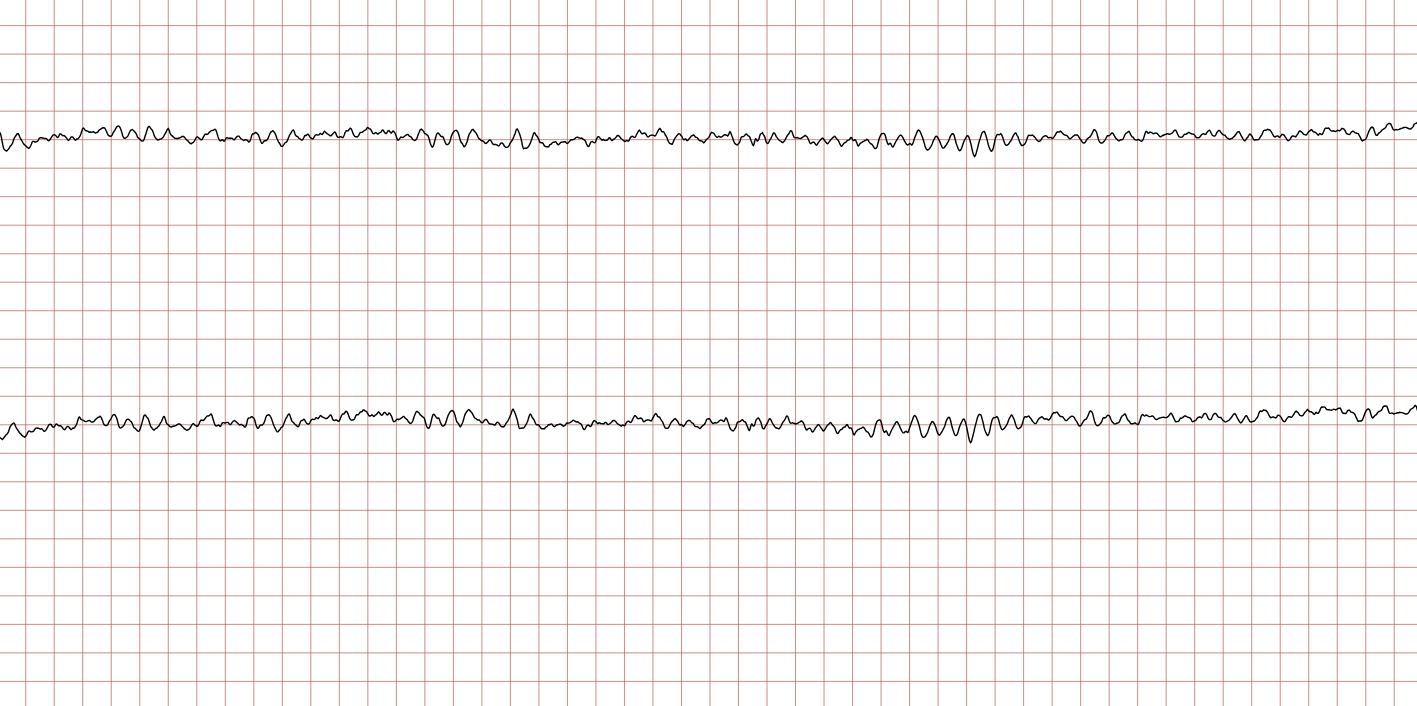
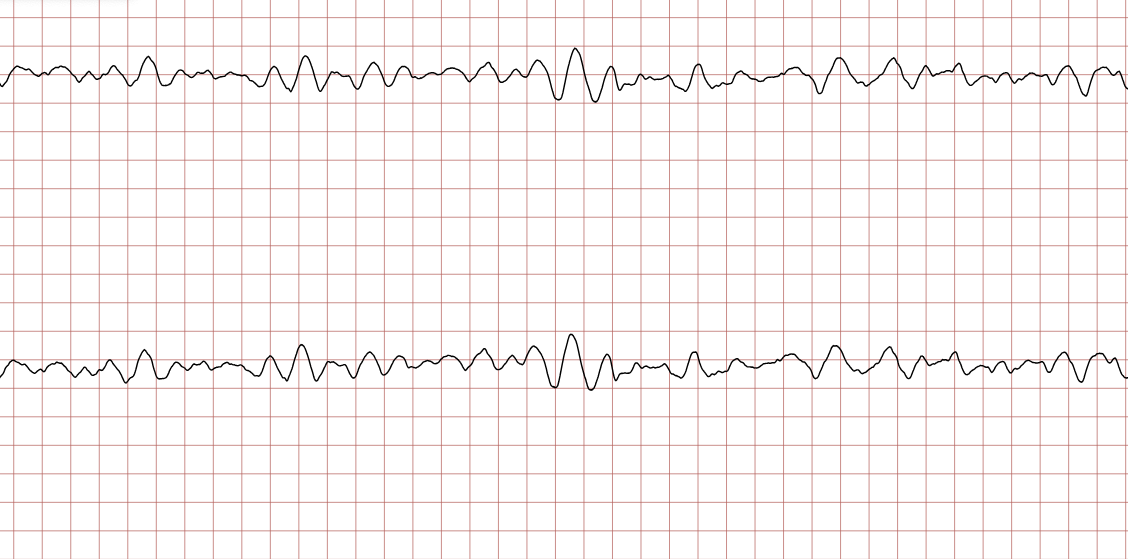
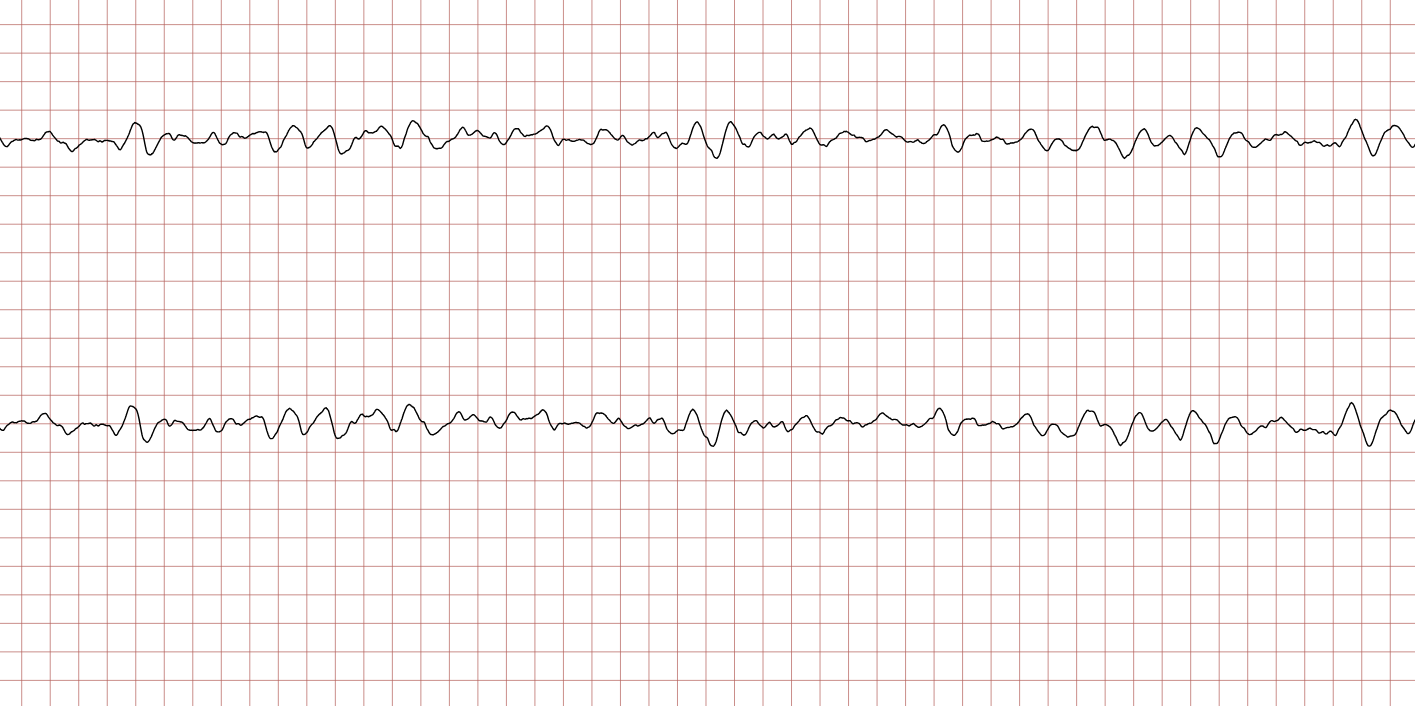
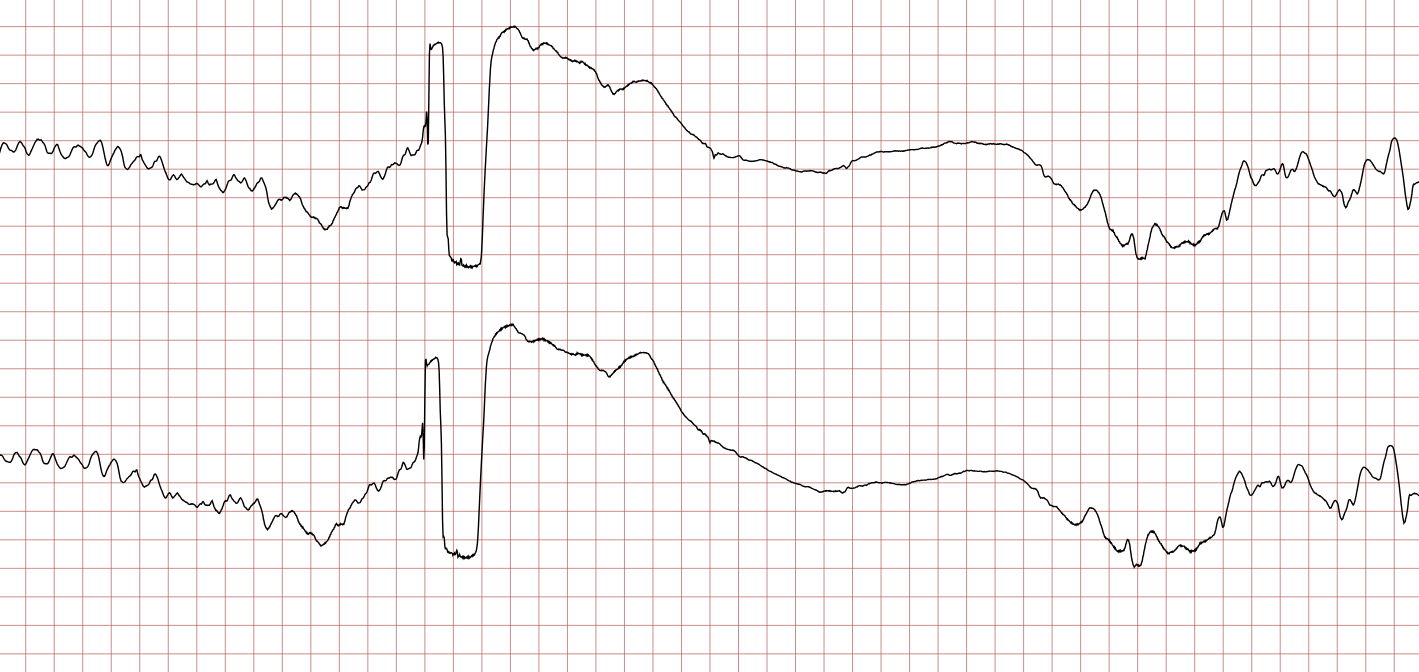
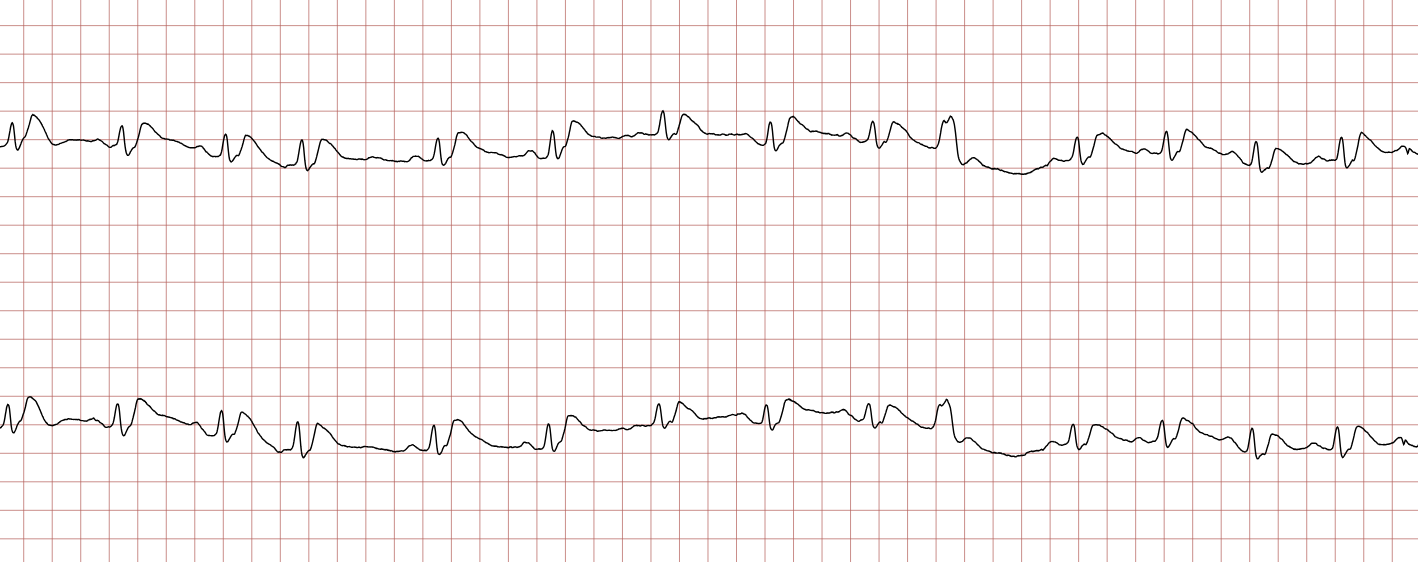
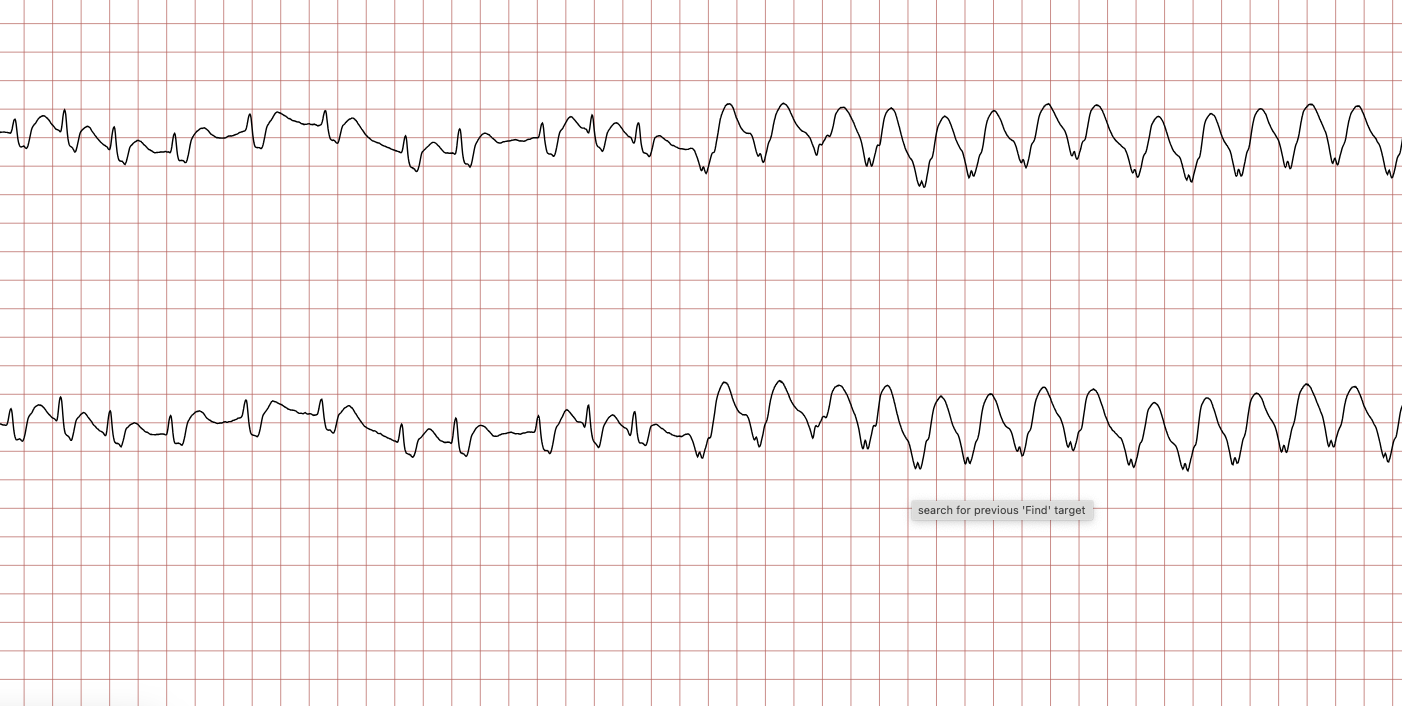
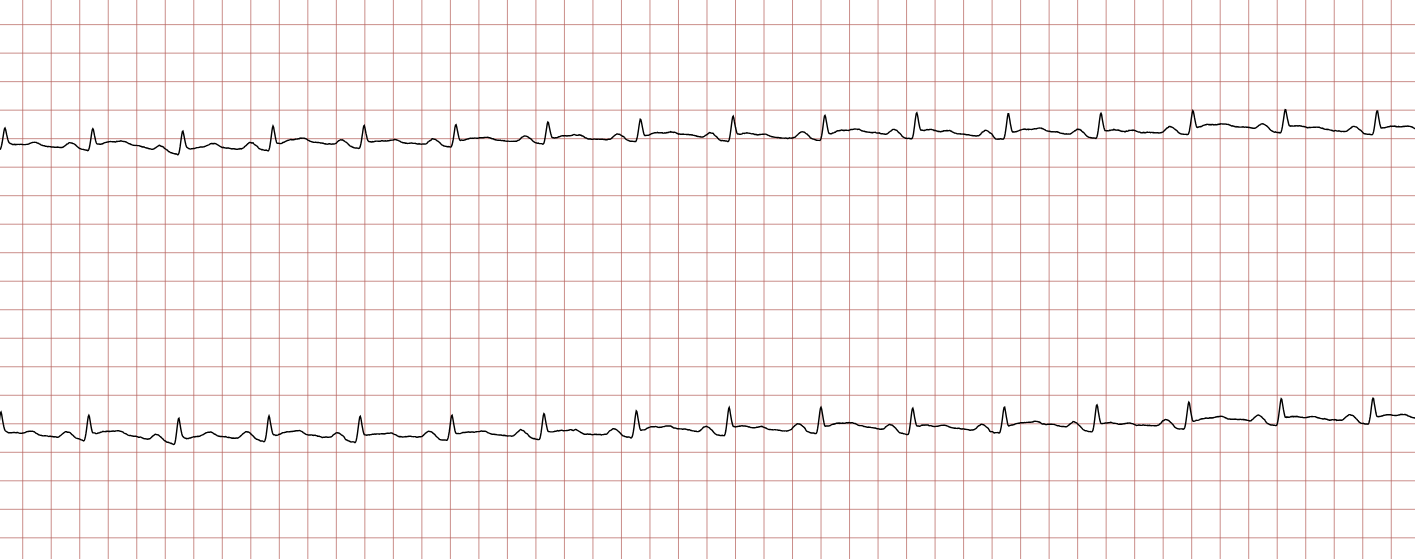
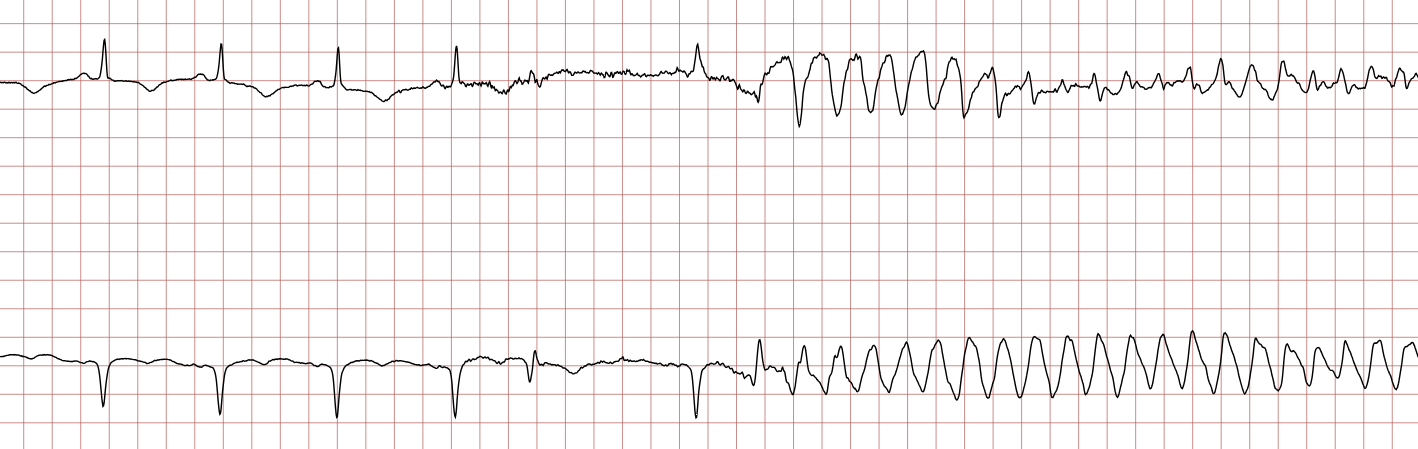
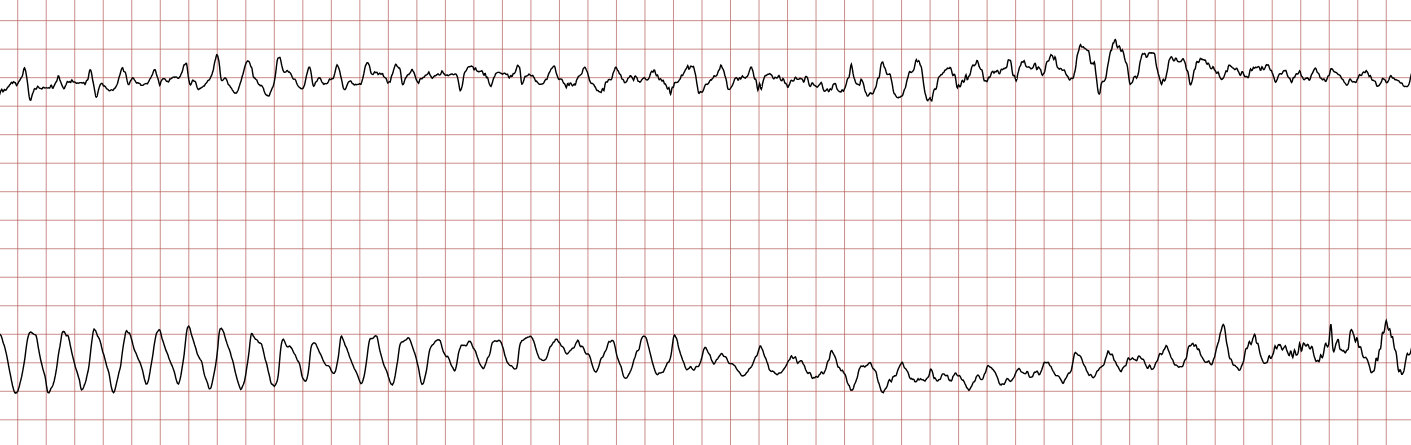
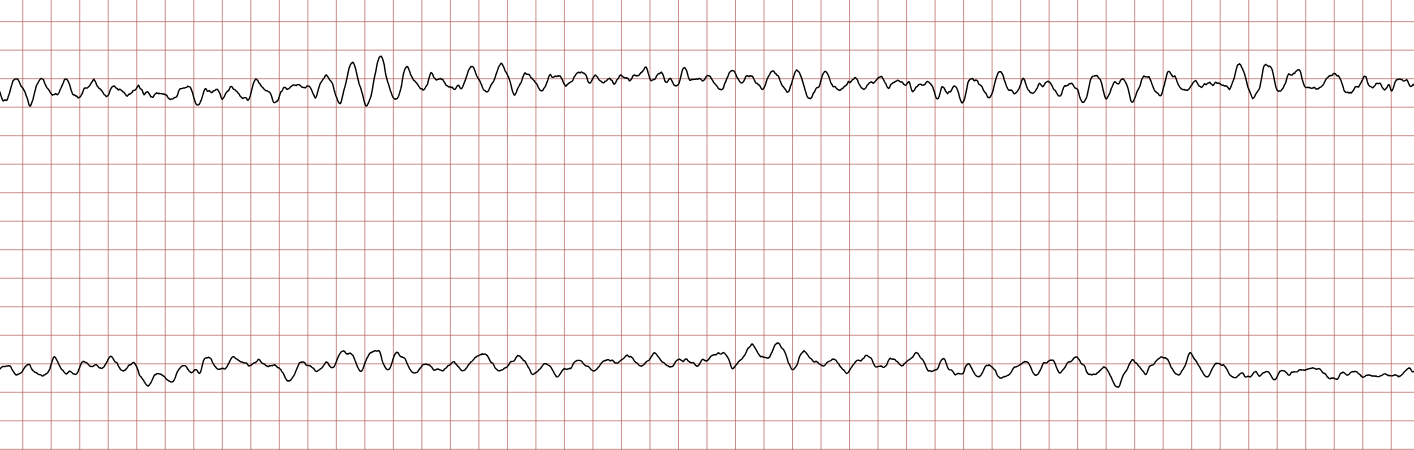
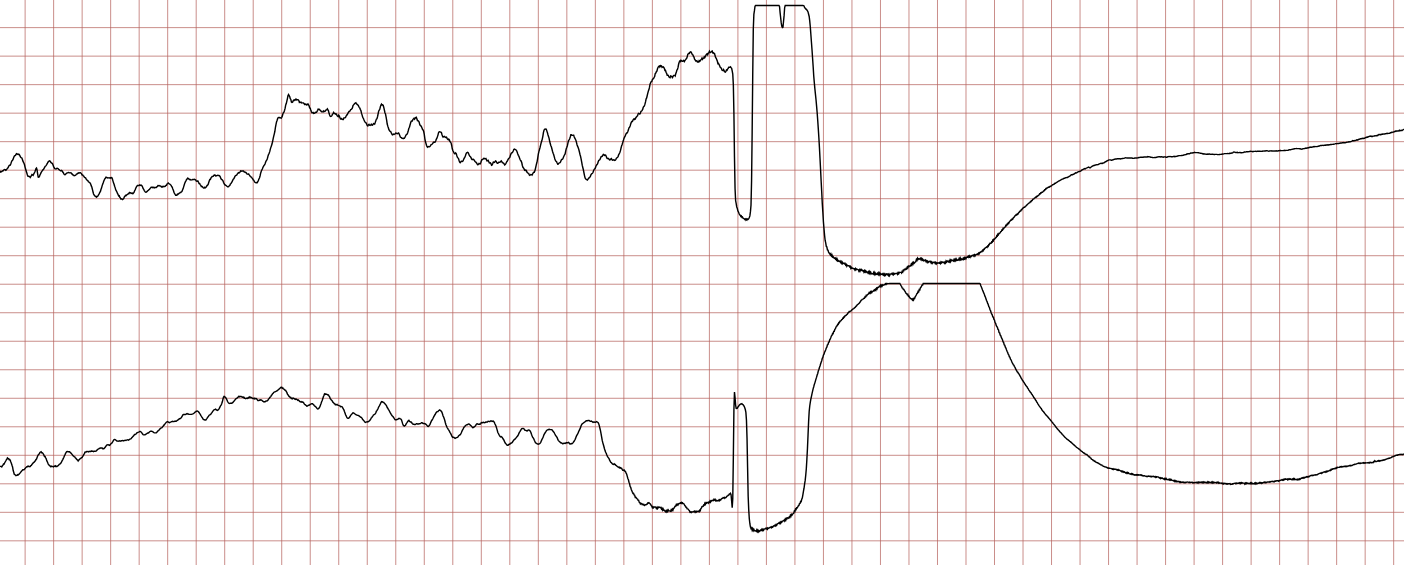
Cas ECG 1 : tachycardie ventriculaire dégénérant en fibrillation ventriculaire
Vous trouverez ci-dessous une série d’enregistrements électrocardiographiques séquentiels effectués lors d’un arrêt cardiaque soudain chez un homme âgé de 43 ans. Chaque tracé présente deux dérivations enregistrées simultanément (moniteur de défibrillateur).
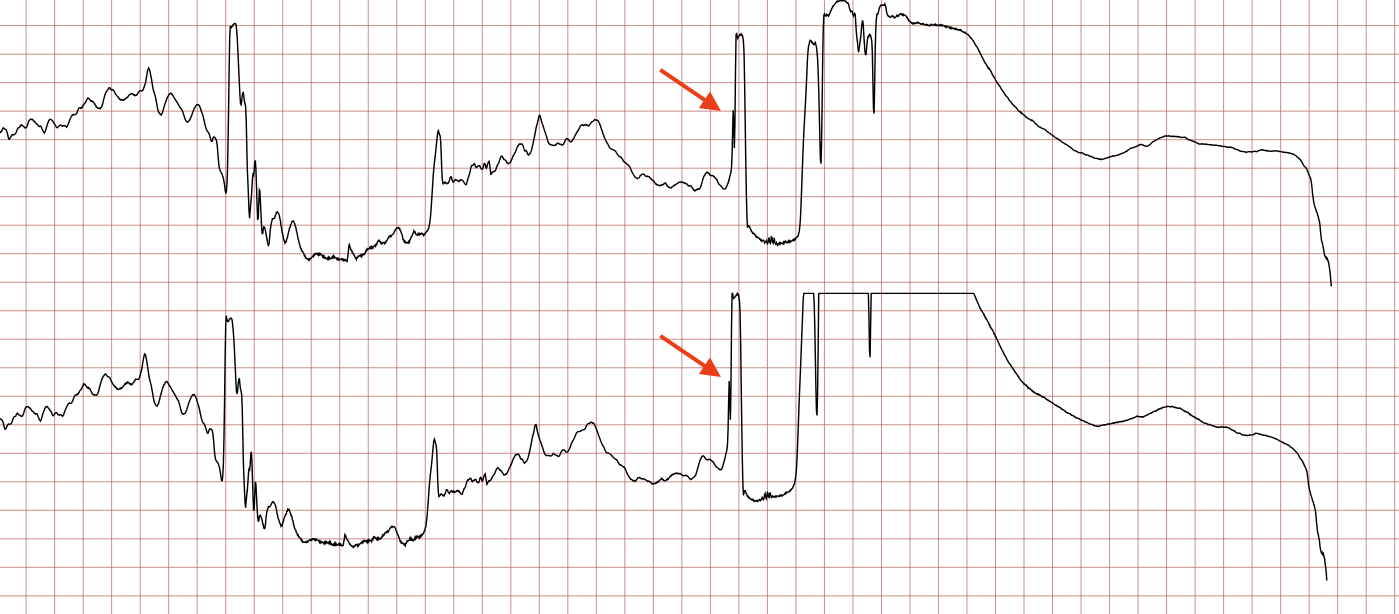
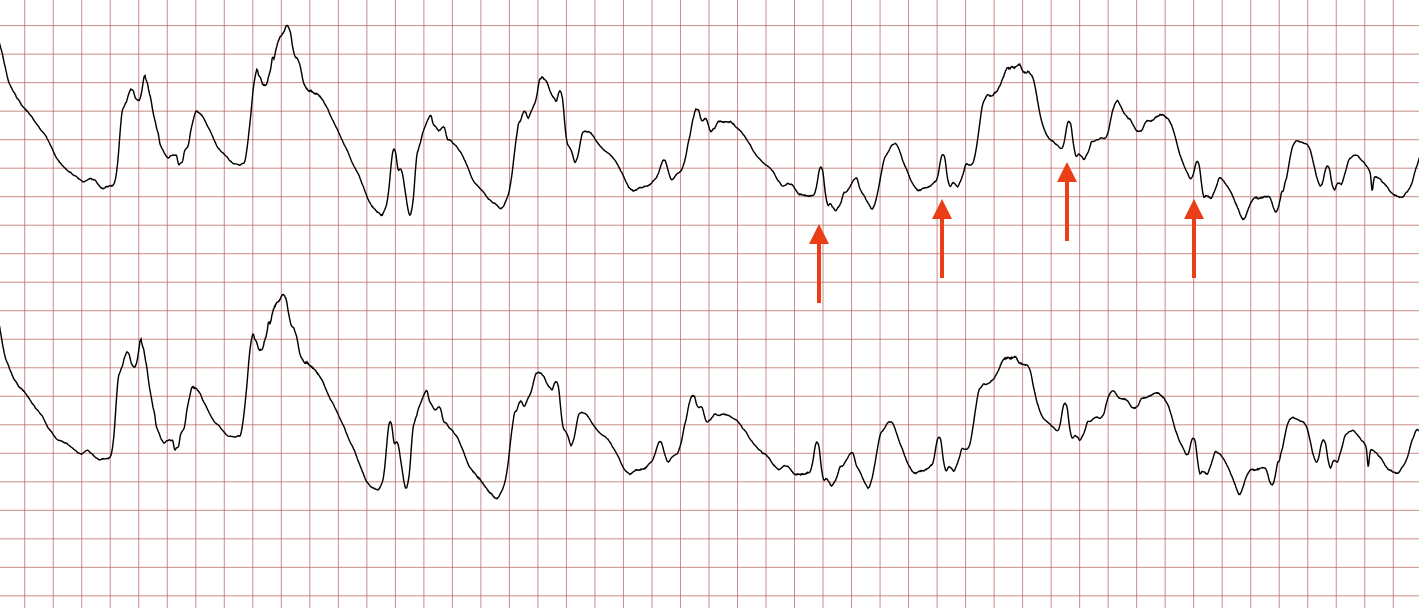
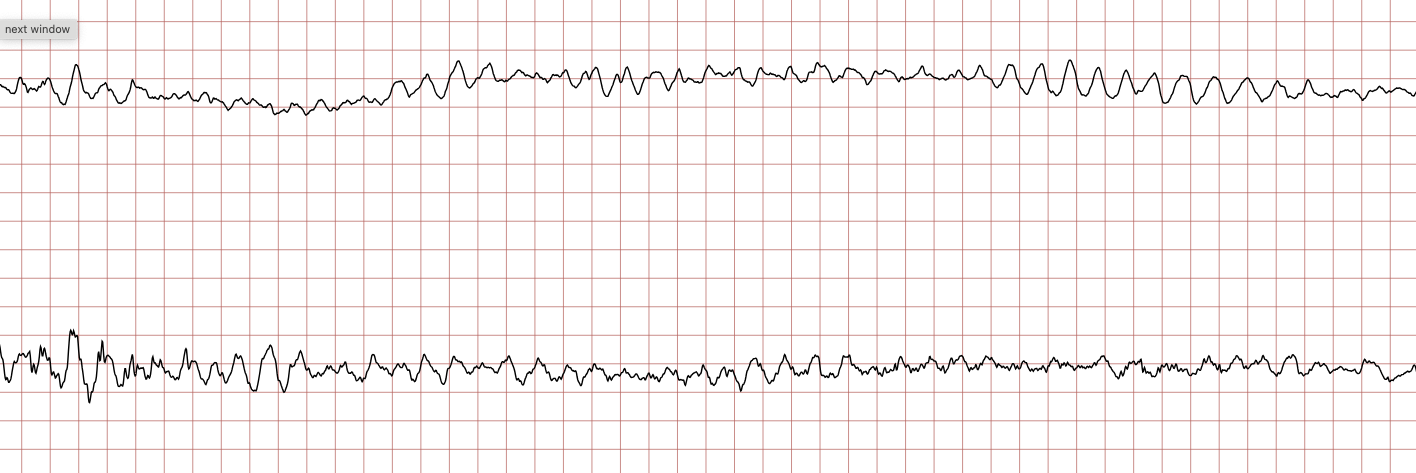
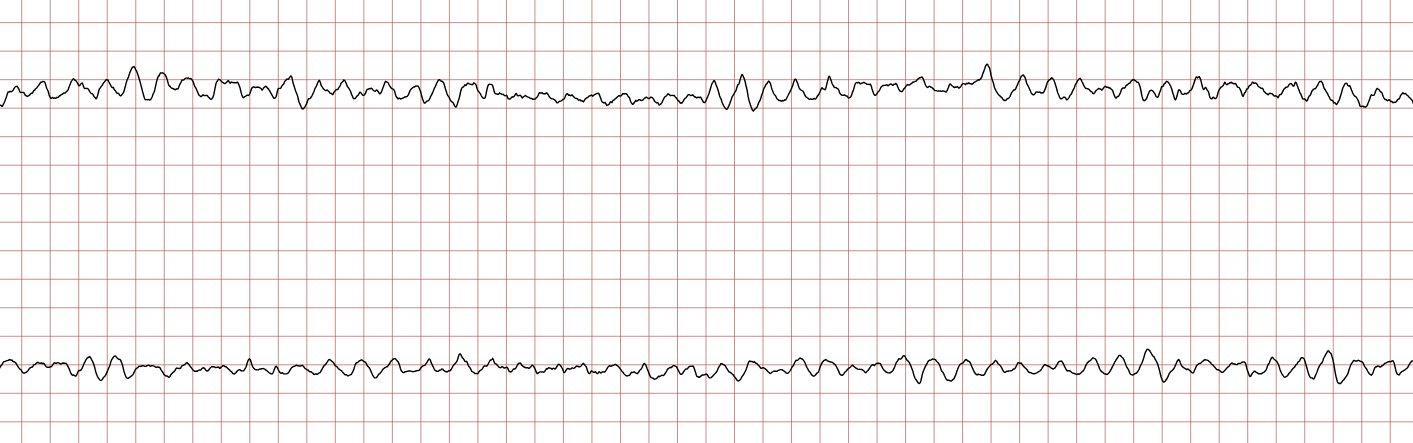
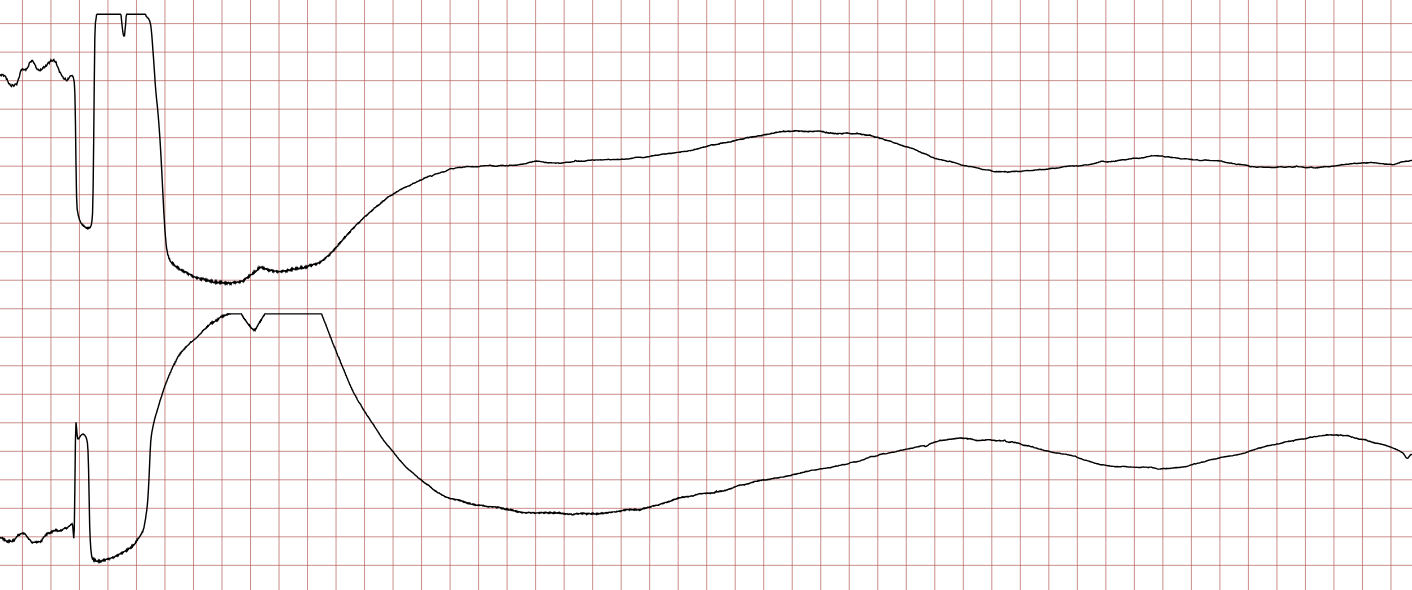
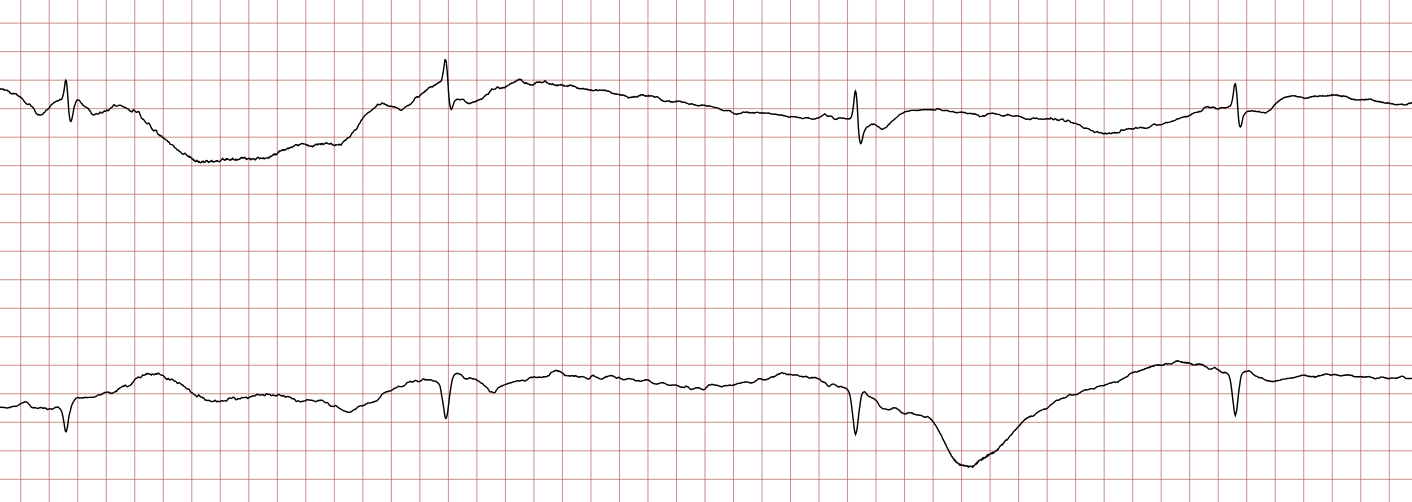
Cas ECG 2 : tachycardie ventriculaire évoluant vers une fibrillation ventriculaire
Vous trouverez ci-dessous des enregistrements ECG séquentiels réalisés lors d’un arrêt cardiaque soudain chez un homme de 62 ans.
Log in to view image, video, quiz, text
Traitement de la fibrillation ventriculaire
La fibrillation ventriculaire est une urgence absolue. La survie diminue d’environ 10 % pour chaque minute écoulée sans défibrillation. La prise en charge doit suivre rigoureusement les algorithmes de réanimation cardiopulmonaire spécialisée (ALS/ACLS) :
- Défibrillation précoce : C’est la pierre angulaire du traitement. Un choc électrique biphasique (généralement 150-200 J, ou maximum disponible) doit être délivré dès que la FV est identifiée.
- Réanimation cardiopulmonaire (RCP) : Les compressions thoraciques de haute qualité doivent être reprises immédiatement après le choc (sans vérifier le pouls ni le rythme) pour une durée de 2 minutes. Elles permettent de maintenir une perfusion coronaire et cérébrale minimale et d’augmenter les chances de succès du choc suivant.
- Pharmacothérapie : Si la FV persiste après deux chocs :
- Adrénaline (Épinéphrine) : 1 mg IV/IO toutes les 3 à 5 minutes pour augmenter la pression de perfusion coronaire par vasoconstriction périphérique.
- Amiodarone : Antiarythmique de choix. 300 mg IV/IO en bolus après le 3ème choc (si FV réfractaire), suivi éventuellement d’une dose de 150 mg. La lidocaïne (1-1,5 mg/kg) est une alternative en l’absence d’amiodarone.
- Recherche des causes réversibles : Simultanément, l’équipe doit rechercher et traiter les causes potentielles (les 4 H et 4 T, voir ci-dessous).
Arrêt cardiaque et mort subite d’origine cardiaque
Pour plus de détails sur l’arrêt cardiaque soudain et la mort subite, veuillez vous référer à la section Arrêt cardiaque soudain et réanimation cardio-pulmonaire (RCP).
L’arrêt cardiaque se définit par la cessation de l’activité mécanique du cœur, entraînant une absence de pouls palpable et de débit sanguin systémique. La mort subite cardiaque (MSC) est un décès naturel inattendu d’origine cardiaque, survenant dans l’heure suivant l’apparition des symptômes chez un sujet dont l’état ne laissait pas présager une issue fatale imminente. La cardiopathie ischémique (maladie coronarienne) est responsable de la grande majorité des cas, souvent par rupture de plaque d’athérome provoquant une ischémie aiguë et une arythmie ventriculaire maligne.
Le mécanisme électrophysiologique final le plus fréquent est une tachyarythmie ventriculaire (TV dégénérant en FV) évoluant vers l’asystolie en l’absence de traitement. L’asystolie représente l’absence totale d’activité électrique (ligne isoélectrique à l’ECG) et signe un épuisement myocardique complet avec un pronostic très sombre.
Causes sous-jacentes
- Cardiopathie ischémique : Cause d’environ 80 % des morts subites. L’ischémie aiguë modifie les propriétés électriques du myocarde, favorisant les réentrées.
- Cardiomyopathies structurelles : Cardiomyopathie dilatée (CMD), cardiomyopathie hypertrophique (CMH), dysplasie arythmogène du ventricule droit (DAVD).
- Causes électriques pures (5-10 %) : Canaux ioniques défectueux sans anomalie structurelle visible (Syndrome du QT long, Brugada, TV polymorphe catécholaminergique).
- Autres causes : Myocardite, valvulopathies (sténose aortique serrée), tamponnade, embolie pulmonaire massive.
Asystolie et brady-asystolie
L’asystolie (ligne plate) témoigne d’une absence d’activité électrique ventriculaire. Avant de conclure à une asystolie, il est impératif de vérifier le gain du monitorage et les connexions (protocole « ligne plate » : vérifier les électrodes, augmenter le gain, changer de dérivation) pour exclure une FV à très fines mailles.
La brady-asystolie (ou activité électrique agonique) se caractérise par des complexes QRS très larges, lents et irréguliers, sans activité mécanique efficace, précédant souvent l’arrêt complet.
Traitement de l’asystolie
Contrairement à la FV, l’asystolie n’est pas un rythme choquable. La défibrillation est inutile et délétère car elle interrompt les compressions thoraciques et lèse le myocarde. Le traitement repose sur :
- RCP de haute qualité immédiate et continue.
- Adrénaline 1 mg IV dès que l’accès veineux est obtenu, à répéter toutes les 3-5 minutes.
- Recherche active des causes réversibles (Hypoxie, Hypovolémie…).
- La stimulation cardiaque externe (pacing) n’est généralement pas efficace en cas d’asystolie confirmée.
Activité électrique sans pouls (AESP)
Synonyme : dissociation électromécanique (DEM)
L’activité électrique sans pouls (AESP) désigne la présence d’une activité électrique organisée à l’ECG (autres que FV ou TV) chez un patient ne présentant pas de pouls palpable. Cela indique que le cœur conserve une activité électrique, mais que celle-ci ne génère pas de débit cardiaque suffisant. On distingue parfois la « vraie AESP » (cœur immobile à l’échographie) de la « pseudo-AESP » (contractions myocardiques visibles à l’échographie mais trop faibles pour générer un pouls perceptible), cette dernière ayant un meilleur pronostic.
Causes de l’AESP : Les 4 H et 4 T
L’AESP est souvent la conséquence d’une pathologie réversible qu’il faut identifier et traiter immédiatement. L’algorithme mnémotechnique universel est celui des « 4 H et 4 T » :
- Hypoxie : Assurer une ventilation et une oxygénation à 100%.
- Hypovolémie : Cause fréquente (hémorragie, déshydratation). Nécessite un remplissage vasculaire rapide et/ou transfusion.
- Hyperkaliémie / Hypokaliémie / Troubles métaboliques : Rechercher des signes ECG évocateurs (ondes T amples, QRS larges). Administrer calcium, bicarbonate ou glucose-insuline selon le cas.
- Hypothermie / Hyperthermie : Réchauffement progressif si nécessaire.
- Thrombose (Coronaire ou Pulmonaire) : L’embolie pulmonaire massive est une cause classique d’AESP (cœur pulmonaire aigu). La thrombolyse peut être envisagée.
- Tamponnade cardiaque : Diagnostic échographique (épanchement péricardique compressif). Nécessite une péricardiocentèse d’urgence.
- Tension (Pneumothorax sous tension) : Décompression à l’aiguille ou thoracostomie immédiate.
- Toxiques : Surdosage médicamenteux (ex: bêta-bloquants, inhibiteurs calciques, tricycliques). Administrer les antidotes spécifiques.
Traitement de l’activité électrique sans pouls
Comme l’asystolie, l’AESP est un rythme non choquable. La prise en charge repose sur :
- RCP de haute qualité.
- Adrénaline 1 mg IV dès que possible (toutes les 3-5 min).
- Identification et traitement de la cause : L’utilisation de l’échographie ciblée (POCUS) pendant les pauses de compressions est cruciale pour identifier une tamponnade, une dilatation du VD (embolie pulmonaire) ou une hypovolémie (cœur vide).