Critères de diagnostic de l’infarctus aigu du myocarde : troponines cardiaques, ECG et symptômes
Infarctus aigu du myocarde : définition et critères
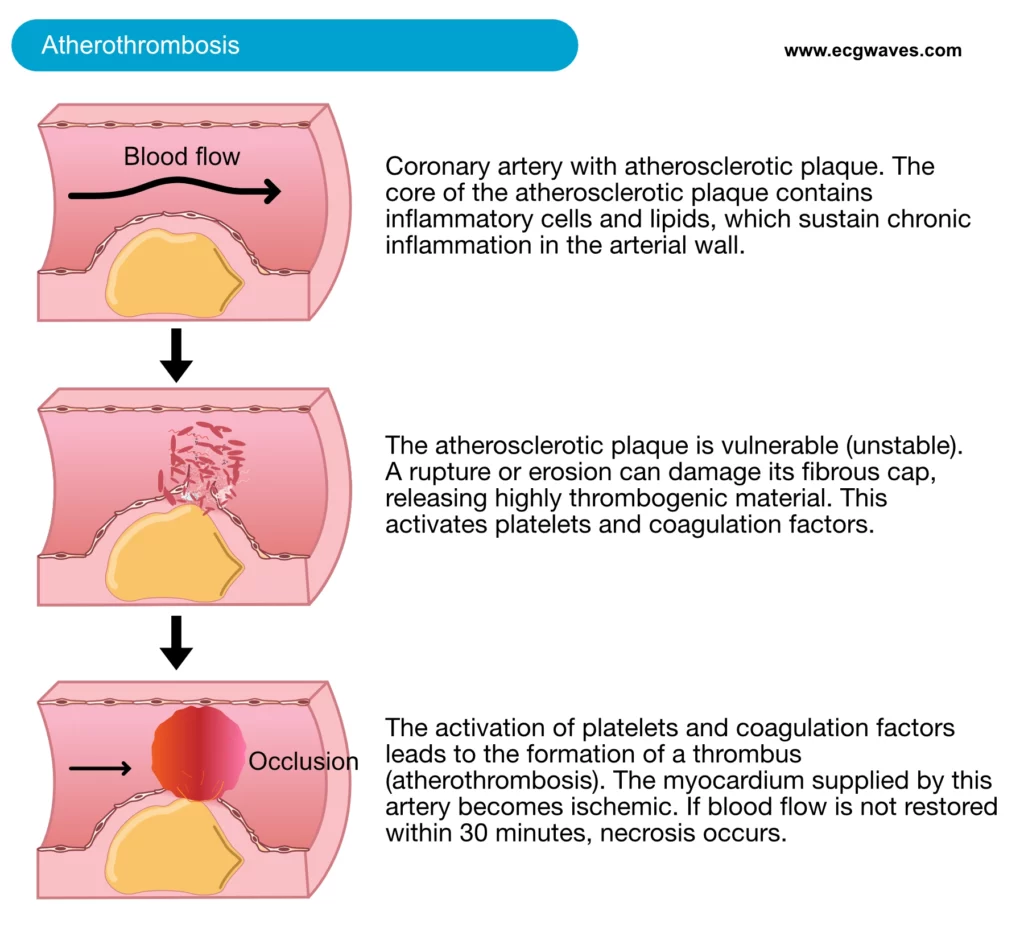
L’infarctus aigu du myocarde (IDM) représente la manifestation la plus critique de la cardiopathie ischémique. Sur le plan physiopathologique, le mécanisme initiateur prédominant est la rupture ou l’érosion d’une plaque d’athérosclérose coronaire vulnérable (plaque instable). Cette déstabilisation expose le collagène sous-endothélial et des matériaux hautement thrombogènes (facteur tissulaire) au flux sanguin, déclenchant l’activation immédiate des plaquettes et de la cascade de coagulation. Ce processus aboutit à la formation d’un thrombus intracoronaire (figure 1).
La rupture de la plaque peut également libérer des débris athéromateux en aval, causant une embolisation microvasculaire qui obstrue les artérioles distales. La conséquence hémodynamique est une interruption partielle ou totale du flux sanguin coronaire. Le myocarde dépendant de l’artère coupable subit alors une ischémie sévère. Si cette ischémie se prolonge, elle conduit inévitablement à la nécrose myocardique (mort cellulaire irréversible), biologiquement objectivée par la libération de protéines intracellulaires cardiaques (troponines) dans la circulation systémique.
Critères de diagnostic de l’infarctus aigu du myocarde
Selon la Quatrième Définition Universelle de l’Infarctus du Myocarde (ESC/ACC/AHA/WHF 2018), le terme clinique d’infarctus aigu du myocarde doit être utilisé lorsqu’il existe une lésion myocardique aiguë (mise en évidence par des biomarqueurs cardiaques anormaux) dans un contexte clinique d’ischémie myocardique aiguë.
Le diagnostic repose sur la combinaison des éléments suivants :
- Troponines cardiaques (cTn) – La détection d’une hausse et/ou d’une baisse des valeurs de cTn, avec au moins une valeur supérieure à la limite supérieure de référence du 99e percentile (LSR), est obligatoire. Cela définit la présence d’une nécrose ou d’une lésion myocardique.
- Preuves cliniques ou paracliniques d’ischémie – En plus des biomarqueurs, au moins l’un des critères suivants doit être présent :
- Symptômes d’ischémie myocardique (douleur thoracique, dyspnée…).
- Nouvelles modifications ischémiques à l’ECG (modifications significatives du segment ST ou de l’onde T, ou bloc de branche gauche présumé nouveau).
- Apparition d’ondes Q pathologiques à l’ECG.
- Preuve par imagerie d’une nouvelle perte de myocarde viable ou d’une nouvelle anomalie régionale du mouvement de la paroi (akinésie/hypokinésie).
- Identification d’un thrombus coronaire par angiographie ou autopsie.
Il est crucial de distinguer la lésion myocardique (myocardial injury), définie uniquement par l’élévation des troponines, de l’infarctus du myocarde, qui nécessite une lésion myocardique ET des preuves d’ischémie aiguë. Une troponine élevée isolée sans signes d’ischémie peut orienter vers d’autres diagnostics (myocardite, insuffisance rénale, sepsis).
Troponines et autres biomarqueurs de la nécrose myocardique (infarctus)
Le myocarde peut tolérer environ 20 à 30 minutes d’ischémie sévère avant que les dommages ne deviennent irréversibles. Au-delà de ce seuil, l’intégrité de la membrane sarcolemmique est compromise, libérant des protéines intracellulaires dans l’interstitium puis dans la circulation sanguine. La troponine cardiaque T (cTnT) et la troponine I (cTnI) sont les biomarqueurs de référence, surpassant largement la CK-MB en termes de sensibilité et de spécificité. Ces protéines sont structurellement liées au complexe contractile du cardiomyocyte et ne sont normalement pas présentes dans le sang circulant.
L’avènement des dosages de troponines cardiaques ultrasensibles (hs-cTn) a révolutionné le diagnostic. Ces tests permettent de détecter des concentrations infimes de troponine, bien en deçà des seuils des anciens dosages. En conséquence, des micro-nécroses focales, qui passaient autrefois inaperçues (diagnostiquées alors comme angor instable), sont désormais classifiées comme NSTEMI (infarctus sans élévation du segment ST). Cela explique le changement épidémiologique observé ces deux dernières décennies : une incidence accrue des NSTEMI au détriment de l’angor instable. Pour approfondir ce changement de paradigme, voir E. Braunwald : Unstable angina : is it time for a requiem ? Circulation, 2013.
Limite de référence pour les troponines
La pierre angulaire de l’interprétation des troponines est la limite supérieure de référence (LSR), fixée au 99e percentile d’une population de référence saine. Toute valeur dépassant ce seuil est considérée comme anormale et témoigne d’une lésion myocardique. Cependant, la valeur absolue doit toujours être interprétée dans le contexte clinique, car la valeur prédictive positive d’une troponine élevée pour un infarctus aigu dépend de la probabilité pré-test (facteurs de risque, symptômes, ECG).
Cinétique des troponines : l’importance du « Delta »
Le diagnostic d’infarctus du myocarde aigu ne repose pas sur une seule valeur isolée, mais sur la cinétique. Il est impératif de démontrer une variation (hausse ou baisse) des taux de troponine entre deux prélèvements. Ce changement relatif ou absolu est appelé le Delta (δ).
Ce schéma dynamique est essentiel pour différencier :
- L’Infarctus Aigu (Lésion aiguë) : Caractérisé par une augmentation rapide puis une décroissance progressive des marqueurs.
- La Lésion Myocardique Chronique : Caractérisée par des niveaux de troponine constamment élevés mais stables (variation < 20 %), comme observé dans l'insuffisance cardiaque structurelle ou la maladie rénale chronique.
Algorithmes de triage rapide (0h/1h et 0h/2h)
Les recommandations actuelles de l’ESC (Société Européenne de Cardiologie) préconisent l’utilisation d’algorithmes de triage rapide utilisant les troponines ultrasensibles. Au lieu d’attendre 6 heures, il est désormais possible de confirmer (rule-in) ou d’exclure (rule-out) un infarctus en répétant le dosage à 1 heure (H1) ou 2 heures (H2) après le premier prélèvement (H0). Une élévation significative à H1 rend le diagnostic de NSTEMI très probable, permettant une prise en charge invasive rapide.
Si les dosages initiaux sont normaux et que la suspicion clinique reste forte, un prélèvement plus tardif (à 3h ou 6h) reste indiqué. Une troponine normale à 6 heures (ou selon le protocole H0/H3) exclut l’infarctus du myocarde avec une très haute valeur prédictive négative.
Diagnostics différentiels d’une troponine élevée
Bien que la troponine soit spécifique du tissu cardiaque, elle n’est pas spécifique de l’étiologie « infarctus par thrombose coronaire ». Toute agression du cardiomyocyte peut provoquer une fuite de troponine. Une cause fréquente de confusion est l’insuffisance rénale chronique, où l’élimination réduite et le remodelage cardiaque chronique contribuent à des taux de base élevés. Dans ce contexte, la cinétique (le changement de valeur) est le seul moyen de diagnostiquer un événement aigu surajouté.
Les causes d’élévation des troponines sont multiples et doivent être connues du clinicien :
- Ischémique : Infarctus du myocarde (Type 1 ou 2), spasme coronaire, embolie coronaire.
- Cardiaque non ischémique :
- Insuffisance cardiaque aiguë ou décompensée.
- Myocardite et péricardite (myopéricardite).
- Syndrome de Takotsubo (cardiomyopathie de stress).
- Contusion cardiaque (traumatisme thoracique).
- Tachyarythmies (FA rapide, TV) ou bradyarythmies sévères.
- Cardioversion électrique, ablation par cathéter.
- Systémique / Autres :
- Embolie pulmonaire (signe de gravité avec souffrance VD).
- Septicémie et choc septique.
- Insuffisance rénale chronique ou aiguë.
- Accident vasculaire cérébral (AVC), hémorragie sous-arachnoïdienne.
- Dissection aortique.
- Rhabdomyolyse sévère avec atteinte cardiaque.
- Chimiothérapies cardiotoxiques.
- Exercice physique extrême (marathon).
Autres biomarqueurs de la nécrose myocardique
Bien que les troponines soient le « Gold Standard », la connaissance des biomarqueurs historiques reste utile, notamment pour l’estimation du timing de l’infarctus ou la détection des récidives précoces (ré-infarctus). La Figure 2 illustre les fenêtres temporelles de ces marqueurs.

CK-MB et Myoglobine
La CK-MB (créatine-kinase fraction MB) est une alternative acceptable si le dosage de troponine n’est pas disponible. Sa durée de vie dans le sang est plus courte (retour à la normale en 48-72h). Cela confère à la CK-MB un avantage spécifique : en cas de suspicion de ré-infarctus dans les jours suivant un premier événement (alors que la troponine est encore élevée en plateau), une nouvelle augmentation de la CK-MB est un indicateur fiable de nouvelle nécrose.
La Myoglobine est une petite protéine libérée très précocement (dès 1-2h). Elle est très sensible mais peu spécifique (présente dans tous les muscles squelettiques). Son utilité clinique a diminué avec l’arrivée des troponines ultrasensibles qui sont détectables presque aussi tôt.
Critères ECG pour l’ischémie et l’infarctus
L’électrocardiogramme (ECG) 12 dérivations est l’outil de diagnostic immédiat. Il doit être réalisé et interprété dans les 10 minutes suivant l’arrivée du patient.
ECG en cas d’ischémie myocardique aiguë
L’ischémie myocardique modifie la repolarisation ventriculaire. Les signes cardinaux sont les déviations du segment ST (sus-décalage ou sous-décalage) et les modifications de l’onde T.
- Sus-décalage du segment ST (ST-Elevation) : Marqueur d’une occlusion coronaire complète et transmurale. Il définit le STEMI et nécessite une reperfusion immédiate. Il est significatif s’il est présent dans au moins deux dérivations contiguës (≥1 mm dans la plupart des dérivations, seuils différents pour V2-V3 selon l’âge et le sexe).
- Sous-décalage du segment ST : Indique généralement une ischémie sous-endocardique. Un sous-décalage horizontal ou descendant ≥ 0,5 mm est fortement évocateur d’ischémie.
- Ondes T :
- Les ondes T amples, symétriques et pointues (suraiguës) sont souvent le tout premier signe d’occlusion coronaire (avant même le sus-décalage ST).
- L’inversion de l’onde T (négativation) peut être un signe d’ischémie, mais une inversion isolée sans modification du segment ST est moins spécifique d’un événement aigu en cours.
La présence d’images en miroir (réciprocité) renforce considérablement la valeur diagnostique d’un sus-décalage du segment ST (ex: sus-décalage en II, III, aVF avec sous-décalage en I, aVL suggère un infarctus inférieur).
L’ECG de nécrose (Séquelles)
L’infarctus du myocarde constitué laisse souvent, mais pas toujours, des traces indélébiles : les ondes Q pathologiques (durée ≥ 0.04s, profondeur significative). Elles traduisent une « fenêtre électrique » à travers le myocarde nécrosé. Une réduction de l’amplitude de l’onde R (rabotage) ou des complexes QRS fragmentés peuvent également être des témoins de cicatrices myocardiques.
Stratification du risque à l’aide de l’ECG
L’ECG initial permet une stratification pronostique immédiate. Le tableau ci-dessous hiérarchise les présentations ECG selon le risque de mortalité.
Tableau 1 : Stratification du risque à l’aide de l’ECG
| ECG | CLASSIFICATION DE L’INFARCTUS | |
| 1 | ECG normal ou non concluant | NSTEMI (si troponines +) |
| 2 | Inversions de l’onde T isolées | NSTEMI |
| 3 | Sous-décalage du segment ST | NSTEMI |
| 4 | Sous-décalage ST et inversion de l’onde T | NSTEMI (Risque élevé) |
| 5 | Bloc de branche gauche (BBG) | Les patients présentant un bloc de branche gauche (BBG) posent un défi diagnostique majeur car le BBG modifie la repolarisation et masque les signes d’ischémie. Selon les recommandations ESC 2017/2018, un patient avec une suspicion clinique d’ischémie et un BBG (qu’il soit nouveau ou ancien) doit être considéré à haut risque. L’utilisation des critères de Sgarbossa (ou Sgarbossa modifiés) peut aider à identifier une occlusion aiguë sur un BBG. Le BBG est associé à un pronostic plus sombre que le sous-décalage ST. Pour plus de détails, voir BBG et Infarctus aigu. |
| 6 | Sus-décalage du segment ST (ST-Elevation) | STEMI |
| 7 | Troubles du rythme ventriculaire / Arrêt cardiaque | STEMI / Mort subite récupérée |
L’étude GUSTO-II (Figure 3) a historiquement démontré la corrélation entre les anomalies ECG et la mortalité à 30 jours. Bien que le STEMI présente la mortalité hospitalière la plus élevée, les patients NSTEMI (souvent plus âgés et polymorbides) conservent un risque de mortalité à long terme très significatif.
Symptômes de l’infarctus aigu du myocarde
La douleur thoracique typique (angor) reste le symptôme cardinal. Elle est classiquement décrite comme une douleur rétrosternale constrictive, une sensation d’étau, de pression intense ou de brûlure. L’irradiation vers le bras gauche, les deux bras, la mâchoire, le cou ou le dos est évocatrice.
Contrairement à l’angor stable, la douleur de l’infarctus :
- Survient souvent au repos.
- Dure plus de 20 minutes.
- Ne cède pas (ou peu) à la prise de dérivés nitrés sublinguaux (Trinitrine).
Présentations atypiques et « équivalents angineux »
Une vigilance particulière est requise chez les femmes, les diabétiques et les personnes âgées, chez qui la douleur thoracique peut être absente (ischémie silencieuse) ou atypique. Les symptômes dits « équivalents angineux » incluent :
- Dyspnée isolée (essoufflement brutal inexpliqué).
- Fatigue extrême soudaine.
- Symptômes digestifs : nausées, vomissements, douleur épigastrique (mimant un reflux ou un ulcère).
- Lipothymie ou syncope.
- Diaphorèse (sueurs froides profuses).
Diagnostics différentiels de la douleur thoracique
Devant une douleur thoracique aiguë, l’objectif est d’éliminer les urgences vitales (le « PIED » : Péricardite, Infarctus, Embolie pulmonaire, Dissection aortique). Les diagnostics différentiels incluent :
- Cardiovasculaire : Angor stable, Péricardite aiguë (douleur positionnelle), Dissection aortique (douleur déchirante migratrice, asymétrie tensionnelle), Embolie pulmonaire.
- Pleuro-pulmonaire : Pneumothorax, Pneumopathie infectieuse, Pleurésie.
- Gastro-intestinal : Reflux gastro-œsophagien (RGO), Spasme œsophagien, Ulcère gastroduodénal, Pancréatite aiguë, Cholécystite (colique hépatique).
- Musculo-squelettique : Syndrome de Tietze (costochondrite), douleurs pariétales, traumatismes.
- Psychogène : Crise d’angoisse, attaque de panique.
- Dermatologique : Zona intercostal (avant éruption).
Place de l’imagerie cardiaque
L’imagerie cardiaque non invasive joue un rôle croissant, tant pour le diagnostic positif que différentiel.
L’Échocardiographie transthoracique (ETT) au lit du patient est recommandée en urgence chez les patients instables ou en cas de doute diagnostique. Elle recherche des anomalies régionales de la contractilité pariétale (hypokinésie ou akinésie segmentaire). Une contractilité normale a une excellente valeur prédictive négative, bien qu’elle n’exclue pas les très petits infarctus. L’ETT permet aussi de dépister d’autres causes (épanchement péricardique, dilatation VD dans l’embolie pulmonaire, flap de dissection aortique).
L’IRM cardiaque est l’examen de référence en cas de diagnostic incertain (ex: troponine élevée avec coronaires saines). Elle permet de distinguer l’infarctus (rehaussement tardif sous-endocardique ou transmural) de la myocardite (rehaussement sous-épicardique) ou du Tako-Tsubo.
Classification clinique de l’infarctus du myocarde
L’infarctus du myocarde n’est pas une entité unique. La classification universelle distingue 5 types basés sur le mécanisme physiopathologique, ce qui guide le traitement.
Les 5 Types d’Infarctus du Myocarde
Type 1 : Infarctus du myocarde spontané (Athérothrombotique) – C’est l’infarctus « classique ». Il est causé par la rupture, l’ulcération, l’érosion ou la dissection d’une plaque d’athérosclérose, entraînant la formation d’un thrombus intraluminal. Le traitement repose sur les antiagrégants, les anticoagulants et la revascularisation.
Type 2 : Infarctus du myocarde par déséquilibre offre/demande (Non thrombotique) – Ici, il y a nécrose ischémique SANS rupture de plaque aiguë. Le mécanisme est un déséquilibre entre l’apport en oxygène (offre) et les besoins du myocarde (demande). Causes fréquentes : tachyarythmie (FA rapide), anémie sévère, hypotension (choc), insuffisance respiratoire hypoxémique, hypertension sévère avec HVG, spasme coronaire ou dissection coronaire spontanée. Le traitement est celui de la cause sous-jacente.
Type 3 : Décès cardiaque ischémique sans biomarqueurs disponibles – Patients décédés avec des symptômes évocateurs d’ischémie et des modifications ECG (ou BBG), mais morts avant le prélèvement sanguin ou avant l’élévation des marqueurs.
Type 4 : Infarctus lié aux interventions coronaires percutanées (ICP)
Type 4a : Lié à la procédure elle-même (ex: occlusion d’une branche collatérale, embolisation distale). Défini par une élévation de cTn > 5 x LSR par rapport à la base (si normale) ou une augmentation > 20%.
Type 4b : Lié à une thrombose de stent documentée (angiographie ou autopsie).
Type 5 : Infarctus lié au pontage aorto-coronarien (PAC) – Défini par une élévation des biomarqueurs > 10 x LSR associée à de nouvelles ondes Q, une occlusion de greffon ou une nouvelle perte de myocarde viable à l’imagerie.
Infarctus à coronaires non obstructives (MINOCA)
Environ 5 à 10 % des patients présentant un tableau d’infarctus aigu (critères cliniques et biologiques remplis) ne présentent pas de sténose significative (>50%) à la coronarographie. C’est ce qu’on appelle le MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries). Les étiologies incluent la rupture de plaque excentrique non visible, l’érosion de plaque, le spasme coronaire épicardique ou microvasculaire, l’embolie coronaire ou la dissection coronaire spontanée. Le diagnostic nécessite souvent une imagerie endocoronaire (OCT/IVUS) ou une IRM cardiaque pour confirmer le mécanisme ischémique et exclure les mimétiques (myocardite).
