STEMI (infarctus du myocarde avec élévation du segment ST) : Diagnostic, ECG, critères et prise en charge
STEMI (infarctus aigu du myocarde avec sus-décalage du segment ST) : épidémiologie, diagnostic (ECG), critères et prise en charge
- Aperçu de la prise en charge
- La chaîne de soins dans la phase aiguë de l’infarctus du myocarde avec sus-décalage du segment ST
- Diagnostic et définition de l’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI)
- Épidémiologie de l’infarctus du myocarde avec sus-décalage du segment ST
- Complications aiguës et à long terme de l’infarctus aigu du myocarde avec sus-décalage du segment ST
- ECG dans l’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI)
- Considérations particulières et équivalents STEMI
- Stratification du risque en phase aiguë
- Prise en charge des patients atteints de STEMI
- La phase préhospitalière
- Le service des urgences
- Traitements médicamenteux de l’infarctus du myocarde avec sus-décalage du segment ST
- Reperfusion : ICP et fibrinolyse
- Références
L’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI) représente la manifestation la plus critique et la plus urgente de la maladie coronarienne athéroscléreuse. Il résulte généralement d’une occlusion thrombotique aiguë et totale d’une artère coronaire épicardique, nécessitant une reperfusion immédiate pour limiter la taille de l’infarctus et préserver la fonction ventriculaire gauche. Ce chapitre traite de la physiopathologie, des définitions, des critères diagnostiques précis et de la prise en charge fondée sur les preuves des patients souffrant d’un STEMI. Bien que les modifications de l’ECG dans l’infarctus aigu du myocarde aient été abordées précédemment, une synthèse ciblée est proposée ci-dessous pour faciliter la reconnaissance immédiate au chevet du patient. La prise en charge de l’infarctus aigu du myocarde avec sus-décalage du segment ST est détaillée, depuis la phase préhospitalière jusqu’aux stratégies de reperfusion et aux thérapies adjuvantes. Les définitions cliniques et les algorithmes thérapeutiques présentés dans ce chapitre sont conformes aux lignes directrices actuelles publiées par l’American Heart Association (AHA), l’American College of Cardiology (ACC) et la Société européenne de cardiologie (ESC). Un vaste corpus de preuves, issu d’essais cliniques contrôlés et randomisés et de registres internationaux, soutient les recommandations présentées ici.
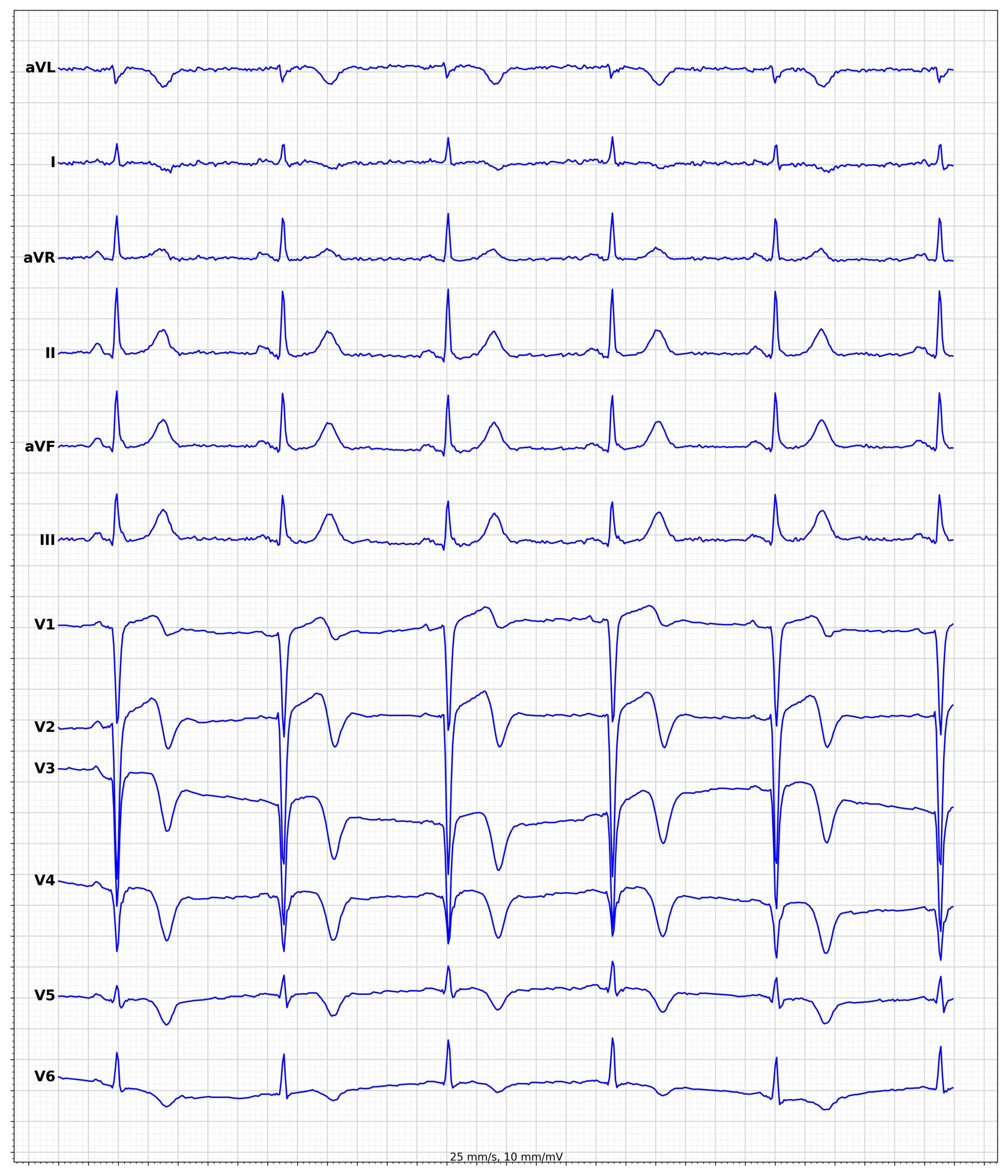
Exemples d’ECG d’infarctus du myocarde avec sus-décalage du segment ST (STEMI)
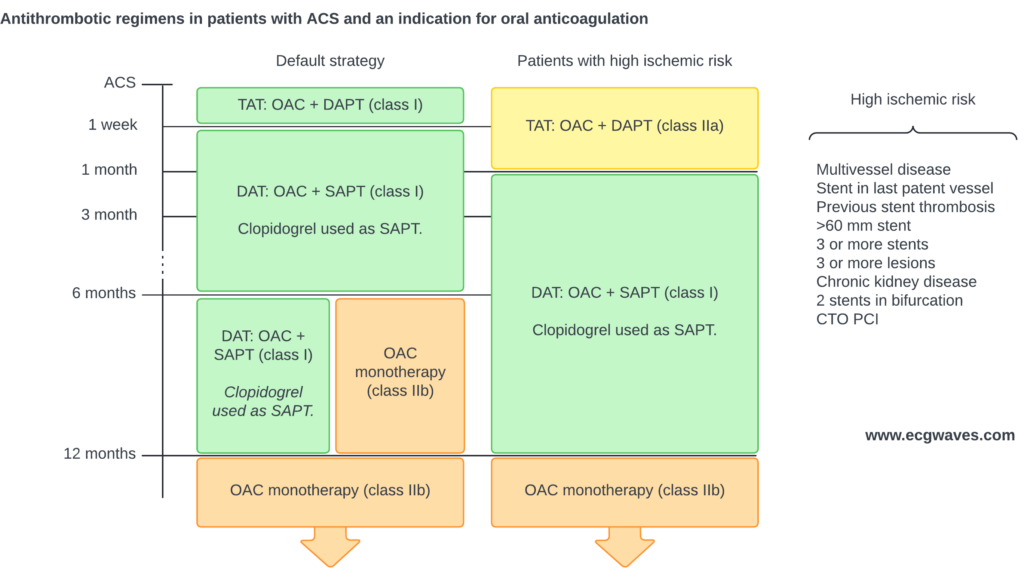
Aperçu de la prise en charge
Cliquez sur le diagramme pour l’agrandir.
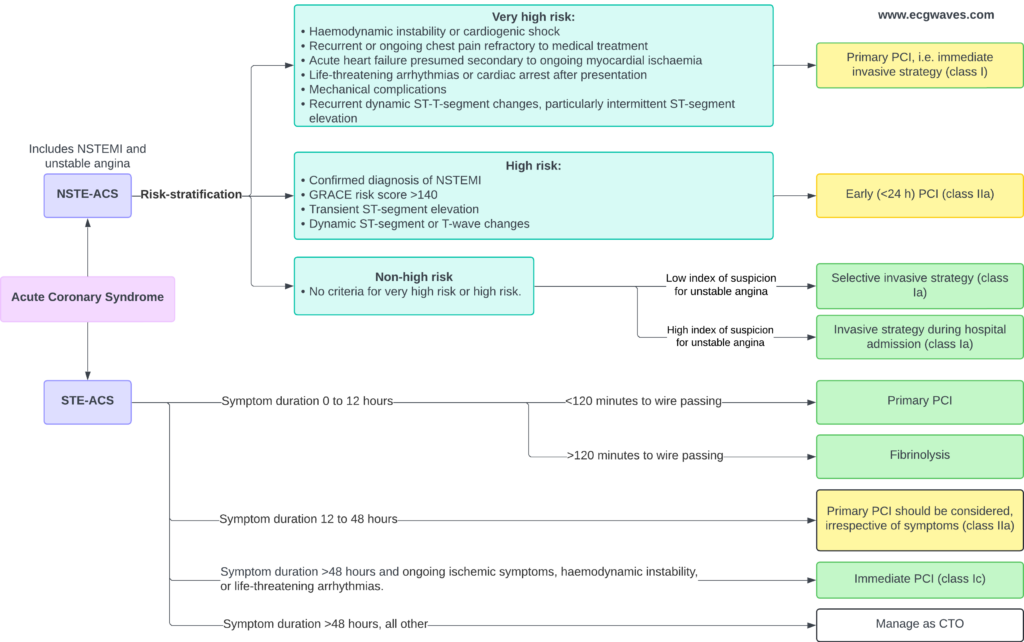
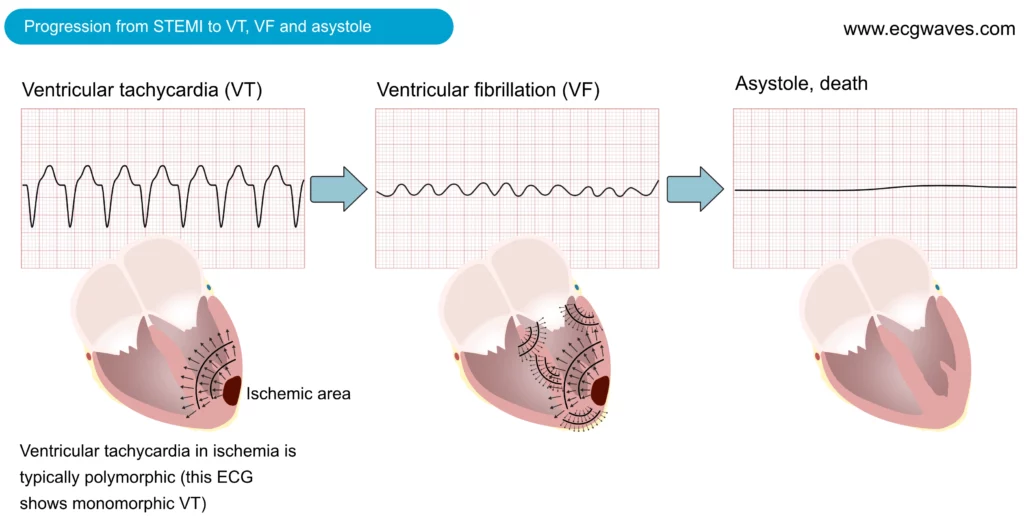
La douleur thoracique (souvent décrite comme une constriction, une pression ou un étau) est le symptôme caractéristique de l’ischémie myocardique et est particulièrement prononcée chez les patients victimes d’un infarctus aigu du myocarde avec sus-décalage du segment ST. Cependant, les présentations atypiques (dyspnée isolée, douleurs épigastriques, nausées) sont fréquentes, notamment chez les femmes, les diabétiques et les personnes âgées. La gravité des symptômes chez les patients victimes d’un STEMI, par rapport à ceux souffrant d’un infarctus du myocarde sans surélévation du segment ST (NSTEMI) ou d’un angor instable (UA), est attribuée à la plus grande étendue de l’ischémie présente dans le cas d’un STEMI. Dans le STEMI, une occlusion complète et brutale de l’artère coronaire entraîne une ischémie transmurale qui affecte rapidement une large zone du myocarde, intensifiant ainsi la douleur thoracique et le risque de nécrose irréversible (« Time is Muscle »). En revanche, le NSTEMI et l’angine de poitrine impliquent généralement des occlusions partielles ou intermittentes, entraînant une ischémie sous-endocardique. Pour la même raison, les patients souffrant d’un infarctus du myocarde avec sus-décalage du segment ST présentent un risque plus élevé d’arythmie ventriculaire maligne au cours de la phase aiguë. La tachycardie ventriculaire (TV) et la fibrillation ventriculaire (FV) peuvent survenir à tout moment, mais le risque est maximal dans les premières heures suivant l’occlusion. En effet, la tachycardie ventriculaire et la fibrillation ventriculaire sont à l’origine de la grande majorité des décès préhospitaliers. Les décès dus à un dysfonctionnement ventriculaire gauche sévère (choc cardiogénique) ou à des complications mécaniques sont moins fréquents immédiatement mais représentent une cause majeure de mortalité hospitalière.
La chaîne de soins dans la phase aiguë de l’infarctus du myocarde avec sus-décalage du segment ST
La prise en charge optimale des patients atteints de STEMI nécessite un système bien coordonné impliquant à la fois des services préhospitaliers et hospitaliers. Dans les grandes communautés, des systèmes régionaux de soins « Réseaux STEMI » ont été mis en place pour identifier et prendre en charge rapidement ces patients, court-circuitant souvent les urgences classiques pour une admission directe en salle de cathétérisme. Cette approche intégrée repose sur une collaboration sans faille entre le centre de répartition (SAMU/Centre 15), les services ambulanciers (SMUR), le service des urgences, le laboratoire de cathétérisme interventionnel et l’unité de soins intensifs cardiologiques (USIC). Chaque composante doit fonctionner de manière cohérente pour minimiser les délais ischémiques. Ce chapitre présente une vue d’ensemble du continuum de soins, de l’évaluation préhospitalière à la sortie de l’hôpital.
Diagnostic de l’infarctus aigu du myocarde avec sus-décalage du segment ST
Le diagnostic repose sur la clinique et l’électrocardiogramme (ECG) 12 dérivations, qui doit être réalisé et interprété dans les 10 minutes suivant le premier contact médical. Le personnel préhospitalier s’est montré capable de reconnaître un STEMI à l’aide d’un ECG à 12 dérivations. La sensibilité, la spécificité, la valeur prédictive positive (VPP) et la valeur prédictive négative (VPN) du personnel des services médicaux d’urgence dans la détection du STEMI sont les suivantes (Ducas et al., Mencl et al.) :
- Sensibilité : Le personnel des SMU fait preuve d’une grande sensibilité dans la détection du STEMI, une étude ayant rapporté une sensibilité de 75 %. Ainsi, 25 % des cas de STEMI peuvent initialement échapper à la détection, soulignant l’importance de la répétition des ECG en cas de symptômes persistants.
- Spécificité : La spécificité est relativement plus faible (53 %), ce qui met en évidence les difficultés à distinguer le STEMI des affections qui en imitent la présentation (péricardite, repolarisation précoce, HVG).
- Valeur prédictive positive (VPP) : La VPP est de 59,5 %, ce qui indique qu’un peu plus de la moitié des cas identifiés comme STEMI par le SAMU sont de vrais positifs.
- Valeur prédictive négative (VPN) : La VPN est exceptionnellement élevée (99,7 %), ce qui suggère que le personnel des services médicaux d’urgence est très fiable lorsqu’il s’agit d’exclure un infarctus du myocarde avec sus-décalage du segment ST lorsqu’il n’est pas présent sur le tracé initial.
Cela met en évidence les forces et les limites du personnel des services médicaux d’urgence dans l’identification préhospitalière du STEMI, en soulignant leur capacité à exclure efficacement le STEMI tout en faisant face à des défis dans la confirmation du diagnostic. Il est important de noter que les patients qui ont recours au SAMU ont des délais de reperfusion plus courts et de meilleurs résultats cliniques, car la pré-activation du laboratoire de cathétérisme permet de mobiliser l’équipe avant l’arrivée du patient.
Point crucial : Le dosage des troponines cardiaques (TnI ou TnT) n’est pas nécessaire pour poser le diagnostic d’infarctus aigu du myocarde avec sus-décalage du segment ST et initier la reperfusion. Le diagnostic opérationnel est basé sur la présentation clinique (douleur thoracique) et les élévations du segment ST persistantes sur l’électrocardiogramme. Attendre les résultats de la troponine pour initier la reperfusion est une erreur clinique majeure qui retarde le traitement et augmente la mortalité.
Principes généraux du traitement
La prise en charge du STEMI implique une combinaison d’agents anti-ischémiques, de thérapies antiplaquettaires, d’anticoagulants (héparines) et de stratégies de reperfusion, telles que l’intervention coronarienne percutanée (ICP) primaire ou la fibrinolyse. La thérapie de reperfusion est la pierre angulaire du traitement et doit être initiée le plus rapidement possible (« Door-to-Balloon » < 90 min ou "FMC-to-Wire" < 120 min), car le STEMI aigu résulte d’une occlusion artérielle complète. Presque tous les patients souffrant d’un STEMI aigu doivent être envoyés au laboratoire de cathétérisme pour une coronarographie urgente. Les thérapies antithrombotiques adjuvantes réduisent de manière significative la mortalité en prévenant la ré-occlusion précoce et en facilitant la recanalisation. La figure 1 présente une vue d’ensemble des stratégies de reperfusion.
Diagnostic et définition de l’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI)
L’infarctus du myocarde avec sus-décalage du segment ST (STEMI) est un syndrome coronarien aigu (SCA) qui se distingue par sa physiopathologie occlusive immédiate. Il existe deux types principaux de syndromes coronariens aigus :
- Le STE-ACS (syndrome coronarien aigu avec sus-décalage du segment ST) est défini par la présence d’un sus-décalage significatif du segment ST sur l’ECG. Si un patient présentant de telles modifications de l’ECG développe un infarctus du myocarde (ce qui est inévitable sans traitement rapide, confirmé ultérieurement par un taux élevé de troponine), l’affection est classée comme STEMI (ST Elevation Myocardial Infarction). L’infarctus du myocarde avec sus-décalage du segment ST n’est formellement diagnostiqué que lorsque l’élévation du taux de troponine a été confirmée ; jusqu’à ce moment, l’affection est classée cliniquement comme STE-ACS. Toutefois, dans la pratique clinique urgente, le STE-ACS et le STEMI sont considérés comme équivalents car la probabilité pré-test d’une occlusion coronaire aiguë est très élevée chez les patients présentant une douleur thoracique et un sus-décalage du segment ST.
- Le syndrome coronarien aigu sans sus-décalage du segment ST (NSTE-ACS) est défini par l’absence de sus-décalage du segment ST à l’ECG. Tous les patients qui ne répondent pas aux critères d’un STEMI seront automatiquement classés dans la catégorie NSTE-ACS. La majorité de ces patients présenteront un taux élevé de troponine, ce qui les classera dans la catégorie NSTEMI (infarctus du myocarde sans sus-décalage du segment ST). Les patients qui ne présentent pas de taux élevés de troponine sont classés dans la catégorie de l’angine de poitrine instable (UA). Les patients atteints de NSTE-ACS présentent généralement des dépressions du segment ST et/ou des inversions de l’onde T ou parfois un ECG normal.
Cette classification des syndromes coronariens aigus est illustrée par la figure 2.
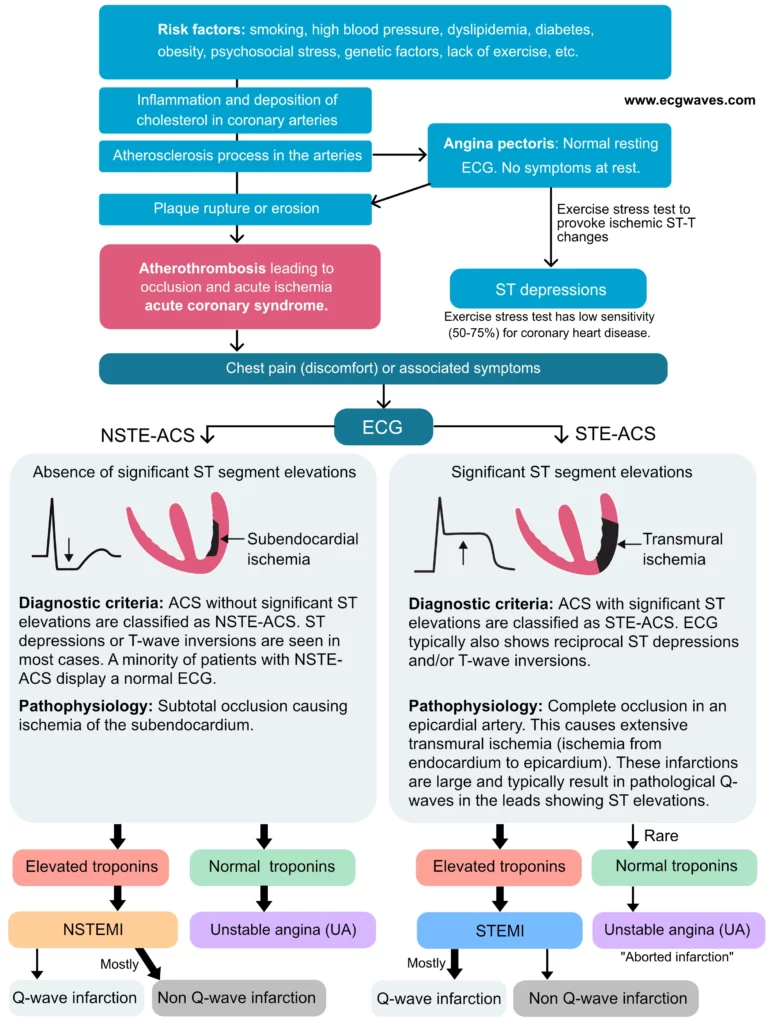
En résumé, le diagnostic d’infarctus aigu du myocarde (IAM) requiert la preuve d’une nécrose myocardique, indiquée par des taux élevés de troponine. La distinction entre le STE-ACS et le NSTE-ACS est purement électrocardiographique mais dicte l’urgence de la revascularisation. Dans le STEMI, l’artère est occluse à 100%, nécessitant une ouverture mécanique ou pharmacologique immédiate.
Physiopathologie du STE-ACS (syndrome coronarien aigu avec sus-décalage du segment ST) et du STEMI
Le STEMI est un syndrome clinique caractérisé par des symptômes d’ischémie myocardique accompagnés d’un sus-décalage du segment ST sur l’ECG. Le mécanisme sous-jacent le plus fréquent est la rupture d’une plaque d’athérosclérose vulnérable (riche en lipides, chape fibreuse fine), exposant le matériel thrombogène sous-endothélial au sang circulant. Cela déclenche une cascade de coagulation rapide, conduisant à la formation d’un thrombus occlusif riche en fibrine (thrombus rouge). Comme l’illustre la figure 1, le STEMI résulte de cette thrombose située généralement dans un segment proximal ou moyen d’une artère coronaire majeure. L’ischémie qui en résulte est transmurale, c’est-à-dire qu’elle touche toute l’épaisseur de la paroi du myocarde, de l’endocarde (le plus sensible à l’ischémie) vers l’épicarde. C’est le phénomène de « vague de front » de la nécrose, qui progresse avec le temps, d’où l’importance cruciale de la rapidité d’intervention.
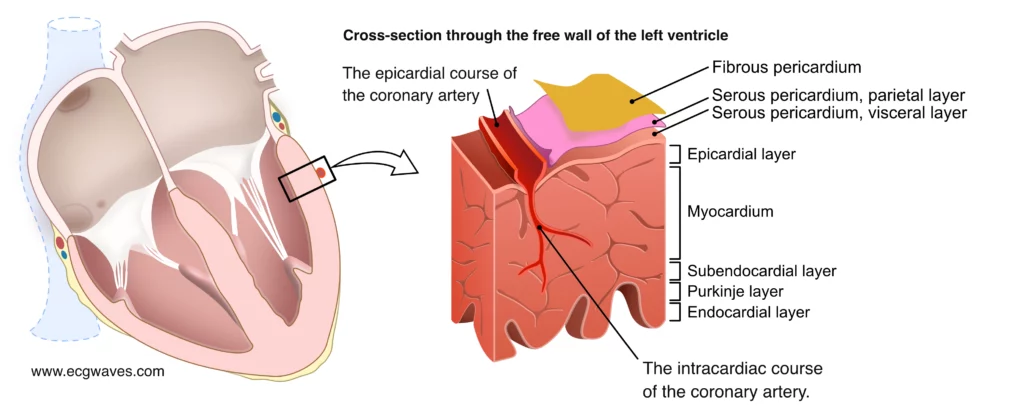
Les vidéos 1 et 2 montrent l’obstruction du flux sanguin chez un patient souffrant d’un STEMI (vidéo 1) et le résultat de l’ICP (vidéo 2).
Vidéo 1 (ci-dessus) : Cette angiographie montre un cathéter placé dans l’artère coronaire circonflexe gauche. L’artère est occluse et n’est donc pas remplie de produit de contraste (flux TIMI 0).
Vidéo 2 (ci-dessus) : Le même patient après l’inflation du ballon et la mise en place d’un stent. Le flux peut maintenant être visualisé dans l’artère (recanalisation, flux TIMI 3) (Todt et al).
Épidémiologie de l’infarctus du myocarde avec sus-décalage du segment ST
Incidence de l’infarctus du myocarde avec sus-décalage du segment ST
En 1990, le STEMI représentait près de 50 % de tous les cas de syndrome coronarien aigu (SCA). Depuis lors, l’incidence du STEMI a régulièrement diminué dans les pays occidentaux, représentant aujourd’hui environ 25 à 40 % de tous les cas d’infarctus aigu du myocarde (IAM). Cette baisse est attribuée à une meilleure prévention primaire et au traitement des facteurs de risque (statines, antihypertenseurs, lutte contre le tabagisme). À l’inverse, l’incidence du NSTEMI a augmenté, en partie en raison de la sensibilité accrue des tests de troponine modernes (troponines ultra-sensibles), qui permettent de détecter des micro-nécroses auparavant non diagnostiquées.
Mortalité dans les cas d’infarctus du myocarde avec sus-décalage du segment ST
La mortalité hospitalière dans les cas de STEMI a diminué de façon spectaculaire, passant de plus de 20% avant l’ère de la reperfusion à environ 5 % actuellement dans les centres disposant d’ICP primaire. La mortalité à un an se situe entre 7 et 18 %. Environ 70 % des patients atteints de STEMI sont des hommes. Les femmes, quant à elles, ont souvent un pronostic plus sombre. Cela est dû à plusieurs facteurs : un âge plus avancé à la présentation, des comorbidités plus fréquentes, un délai plus long entre l’apparition des symptômes et le premier contact médical, et une présentation souvent atypique conduisant à un sous-diagnostic ou un sous-traitement (Smilowitz et al.). Près d’un patient sur quatre souffrant d’un infarctus du myocarde avec sus-décalage du segment ST est diabétique, ce qui confère un pronostic plus sévère en raison de la maladie coronarienne diffuse souvent associée et du risque accru d’insuffisance cardiaque.
Complications aiguës et à long terme de l’infarctus aigu du myocarde avec sus-décalage du segment ST
L’infarctus aigu du myocarde, en particulier l’infarctus du myocarde avec sus-décalage du segment ST, peut entraîner de multiples complications. Des arythmies potentiellement mortelles (TV/FV) dominent la phase très précoce. Les complications mécaniques, bien que devenues plus rares grâce à la reperfusion précoce, restent catastrophiques.
Rupture du muscle papillaire (RMP)
La rupture du muscle papillaire (RMP) survient chez moins de 1 % des patients, généralement dans les 2 à 7 jours suivant l’infarctus. Le muscle papillaire postéro-médial est le plus souvent affecté (10 fois plus que l’antéro-latéral) car il dépend d’une vascularisation unique (souvent l’IVP issue de la coronaire droite). La rupture entraîne une insuffisance mitrale aiguë massive, un œdème pulmonaire flash et un choc cardiogénique. Le diagnostic est suspecté devant un nouveau souffle systolique (parfois absent si pressions égalisées) et confirmé par l’échocardiographie. Le traitement est chirurgical en urgence.
Rupture du septum interventriculaire (CIV post-infarctus)
La rupture septale, créant une communication interventriculaire (CIV), est une complication redoutable survenant typiquement 3 à 5 jours après un infarctus transmural antérieur ou inférieur étendu. Elle se manifeste par une détérioration hémodynamique brutale et un souffle holosystolique intense, « en rayon de roue », le long du bord sternal gauche. L’échocardiographie confirme le shunt gauche-droit. La mortalité est extrêmement élevée (>90% sans chirurgie). Le traitement repose sur le support hémodynamique (ballon de contre-pulsion, ECMO) en pont vers une chirurgie réparatrice.
Rupture de la paroi libre du ventricule gauche
C’est une complication catastrophique conduisant souvent à la mort subite par tamponnade péricardique (dissociation électromécanique). Elle survient généralement dans les 5 premiers jours. Les signes précurseurs sont rares, mais peuvent inclure une douleur thoracique récurrente de type péricarditique ou une hypotension soudaine. La survie dépend d’une reconnaissance immédiate, d’une péricardiocentèse de sauvetage et d’une chirurgie d’urgence.
Anévrisme et pseudo-anévrisme ventriculaire
Un anévrisme vrai (large collet, paroi myocardique fine) peut se développer tardivement après un infarctus transmural, favorisant la formation de thrombus et les arythmies. Un pseudo-anévrisme (faux anévrisme, collet étroit) résulte d’une rupture contenue par le péricarde ; le risque de rupture secondaire est très élevé, nécessitant une correction chirurgicale urgente.

ECG dans l’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI)
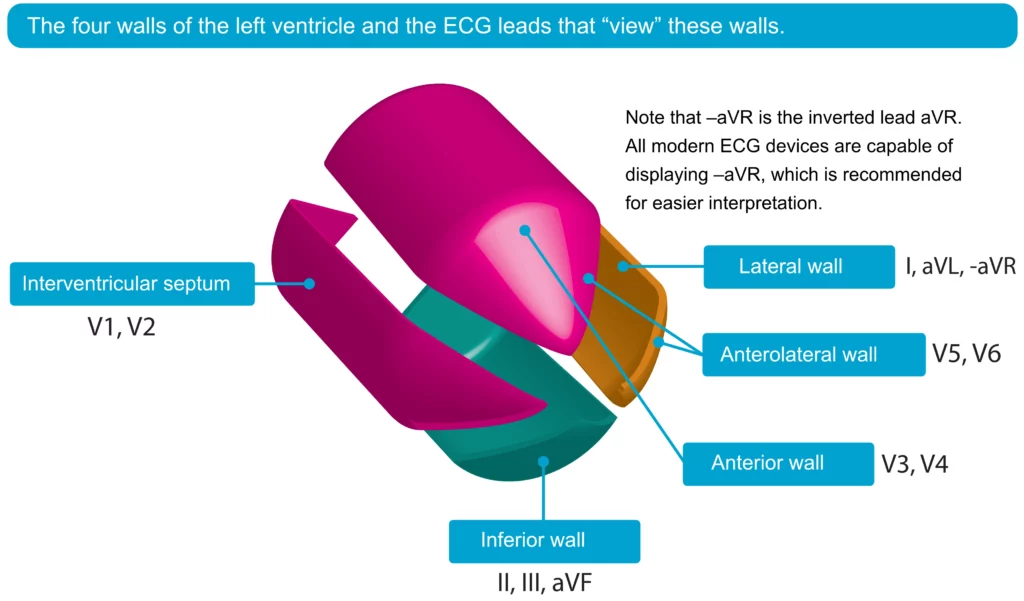
L’ECG est la clé du diagnostic. Le sus-décalage du segment ST est mesuré au point J (jonction entre la fin du complexe QRS et le début du segment ST) et doit être présent dans au moins deux dérivations contiguës. Les dérivations contiguës reflètent des zones anatomiques voisines : antérieures (V1-V6), inférieures (II, III, aVF) et latérales (I, aVL).
Une élévation du point J de ≥1 mm est le seuil standard, sauf pour les dérivations précordiales septales (V2-V3) où les seuils sont plus élevés en raison des variantes de repolarisation normales, particulièrement chez les hommes jeunes. Reportez-vous au tableau 1 pour les critères précis.
Tableau 1 : Critères ECG pour le diagnostic d’un infarctus aigu du myocarde avec sus-décalage du segment ST
- Nouveau sus-décalage du segment ST dans au moins deux dérivations anatomiques contiguës (mesuré au point J) :
- Hommes âgés de ≥40 ans : ≥2 mm (0,2 mV) dans V2-V3 et ≥1 mm (0,1 mV) dans toutes les autres dérivations.
- Hommes âgés de moins de 40 ans : ≥2,5 mm (0,25 mV) dans V2-V3 et ≥1 mm dans toutes les autres dérivations.
- Femmes (tout âge) : ≥1,5 mm (0,15 mV) dans V2-V3 et ≥1 mm dans toutes les autres dérivations.
- Dérivations droites V4R et V3R (pour IDM ventriculaire droit) : ≥0,5 mm, sauf pour les hommes de moins de 30 ans pour lesquels le critère est ≥1 mm.
- Dérivations postérieures V7-V9 : ≥0,5 mm (pour IDM basal/postérieur).
La localisation de l’infarctus influence la prise en charge et le pronostic. Les infarctus antérieurs sont associés à un risque plus élevé de dysfonctionnement ventriculaire gauche et de choc, tandis que les infarctus inférieurs peuvent se compliquer de bradycardies (bloc AV) et d’atteinte du ventricule droit. La figure 5 fournit une représentation visuelle des corrélations anatomo-électriques.
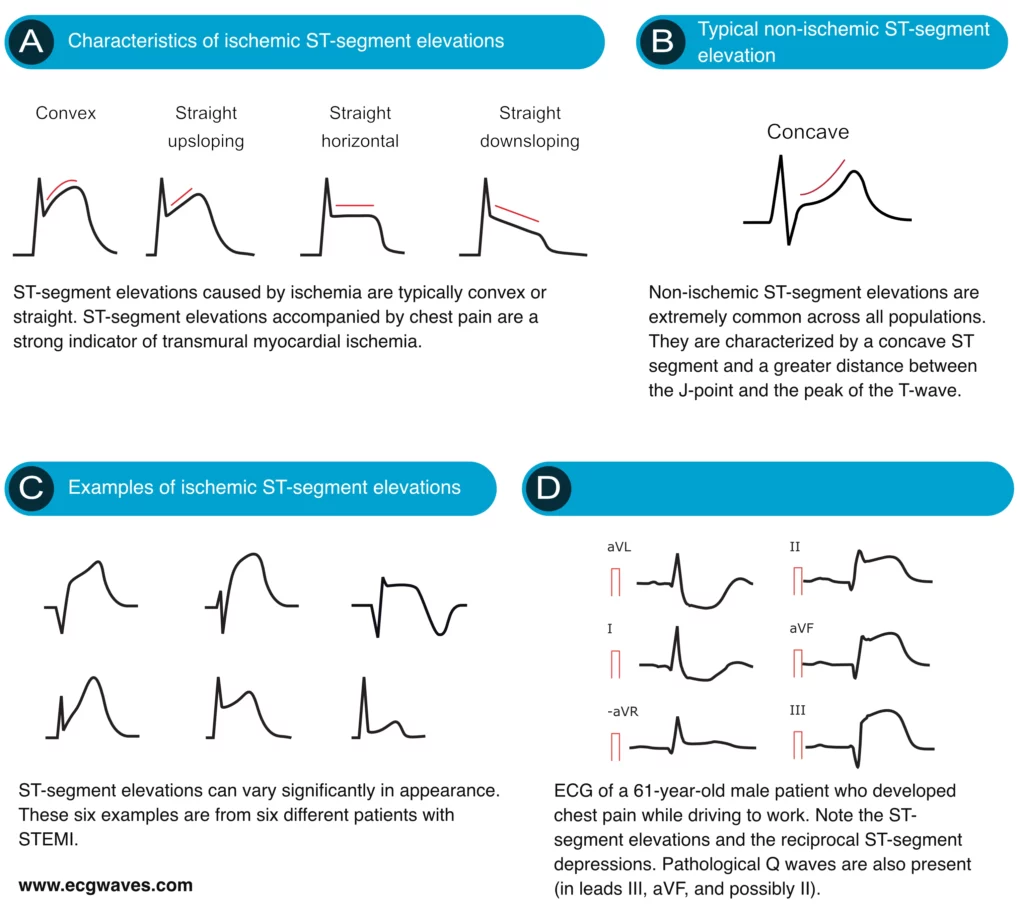
Caractéristiques des sus-décalages ischémiques du segment ST
La morphologie du segment ST est cruciale. Les sus-décalages convexes vers le haut (aspect en « dôme » ou « Pardee ») ou droits sont fortement évocateurs d’un STEMI (Figure 6A). À l’inverse, les élévations concaves sont souvent associées à la péricardite ou à la repolarisation précoce (Figure 6B), bien que cela ne soit pas un critère absolu d’exclusion d’un infarctus.
Autres causes de sus-décalage du segment ST
Le diagnostic différentiel est large (Panneau 2). L’interrogatoire et le contexte clinique sont essentiels pour différencier un STEMI d’une péricardite (douleur pleurétique, sus-décalage diffus) ou d’une repolarisation précoce (patient jeune, asymptomatique, sus-décalage stable).
Panneau 2. Diagnostics différentiels des élévations du segment ST
- Modèle masculin/féminin (“élévation normale du segment ST”)
- Syndrome de repolarisation précoce
- Hypertrophie ventriculaire gauche (HVG)
- Bloc de branche gauche (BBG)
- Péricardite aiguë (myocardite, périmyocardite)
- Hyperkaliémie (souvent avec QRS large, ondes T pointues)
- Syndrome de Brugada
- Embolie pulmonaire (rarement sus-décalage en V1-V3, plus souvent S1Q3T3 ou T négatives antérieures)
- Dissection aortique (peut causer un STEMI par dissection de l’ostium coronaire, généralement droit)
- Cardiomyopathie ventriculaire droite arythmogène (dysplasie) – ARVD/ARVC
- Pré-excitation (syndrome de Wolff-Parkinson-White)
- Cardioversion électrique
- Cardiomyopathie de Takotsubo (syndrome du cœur brisé, imite parfaitement un STEMI antérieur)
- Angine de Prinzmetal (vasospasme, sus-décalage transitoire répondant aux nitrés)
- Hypothermie et hypercalcémie
- Anévrisme du ventricule gauche (sus-décalage persistant post-IDM)
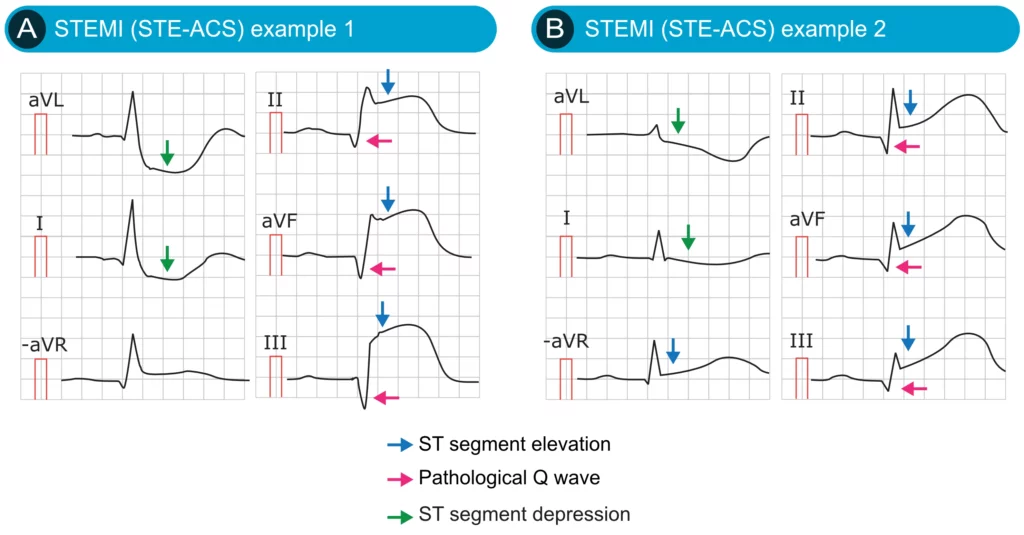
Dépressions réciproques du segment ST (Images en miroir)
La présence de dépressions réciproques du segment ST (sous-décalages) dans les dérivations opposées à la zone infarcie est un signe de très haute spécificité pour l’infarctus du myocarde. Elle permet souvent de confirmer le diagnostic en cas de sus-décalage limite. Par exemple, un STEMI inférieur (II, III, aVF) s’accompagne quasi-systématiquement d’un sous-décalage en aVL (et souvent en I). La figure 7 présente deux patients présentant un STEMI aigu et des dépressions réciproques évidentes.
Considérations particulières et équivalents STEMI
Certains patients présentent une occlusion coronaire aiguë sans sus-décalage classique du segment ST, mais nécessitent une reperfusion tout aussi urgente. Ces situations sont des « équivalents STEMI ».
Bloc de branche gauche (BBG) chez les patients atteints d’un infarctus aigu du myocarde
Le BBG complique l’évaluation car il modifie la repolarisation basale. Traditionnellement, un BBG présumé nouveau avec douleur thoracique était considéré comme un STEMI. Les directives actuelles sont plus nuancées :
- Le BBG peut masquer l’ischémie : Les anomalies secondaires de repolarisation du BBG (discordance appropriée) cachent les courants de lésion.
- Les critères de Sgarbossa (et la règle de Sgarbossa modifiée par Smith) sont essentiels pour diagnostiquer un IDM sur BBG. Ils recherchent une concordance pathologique (sus-décalage dans une dérivation à QRS positif) ou un sus-décalage excessivement discordant. Voir la section BBG et infarctus aigu du myocarde pour les détails.
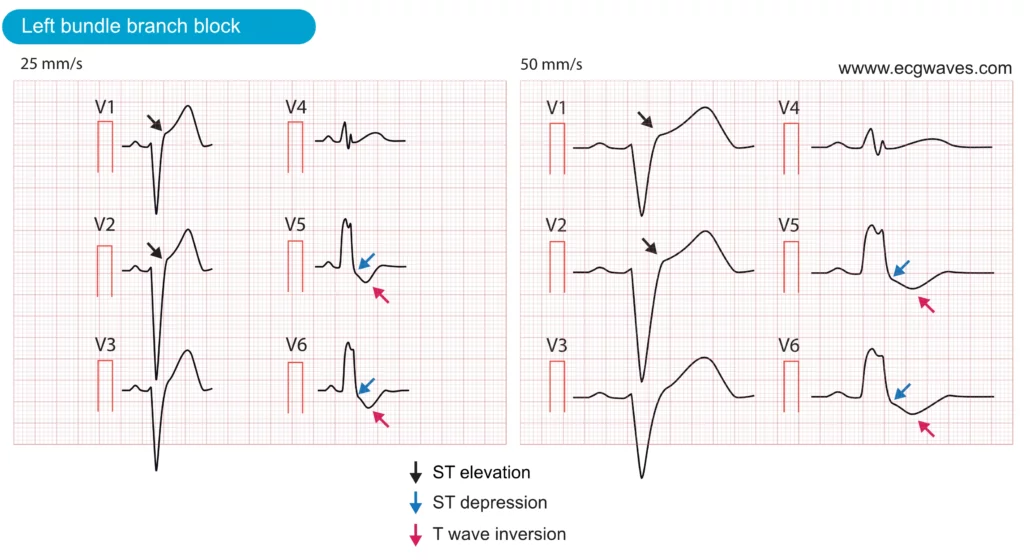
STEMI sans sus-décalage du segment ST visible : Infarctus Postérieur et autres
- Infarctus postérieur (basal) : L’artère circonflexe occluse peut ne pas provoquer de sus-décalage sur l’ECG standard. Le signe clé est un sous-décalage horizontal du segment ST en V1-V3 (image en miroir). L’enregistrement des dérivations postérieures (V7, V8, V9) montrera alors un sus-décalage.
- Infarctus du ventricule droit : Suspecté devant un infarctus inférieur avec hypotension ou turgescence jugulaire. Nécessite l’enregistrement des dérivations droites (V3R, V4R).
- Occlusion du tronc commun ou tri-tronculaire : Un sous-décalage diffus du segment ST (≥ 6 dérivations) associé à un sus-décalage en aVR (et souvent en V1) indique une ischémie globale sévère. C’est une urgence chirurgicale ou interventionnelle majeure.
- Signe de de Winter : Un sous-décalage ascendant du point J en V1-V6 couplé à des ondes T hautes, symétriques et proéminentes. C’est un signe très spécifique d’occlusion aiguë de l’artère interventriculaire antérieure (IVA) proximale, considéré comme un équivalent STEMI.
Ondes T hyperaiguës
Les ondes T hyperaiguës (larges, amples, symétriques) sont la toute première manifestation ECG de l’occlusion coronaire, précédant parfois le sus-décalage du segment ST de quelques minutes. Leur reconnaissance permet un diagnostic ultra-précoce.
Stratification du risque en phase aiguë
L’évaluation précoce du risque (scores TIMI et GRACE) aide à guider l’intensité thérapeutique. Le score GRACE est particulièrement performant pour prédire la mortalité hospitalière et à 6 mois.
Calculateur du score de risque TIMI pour le STEMI
[calc_timi]
Interprétation du score TIMI
| Points | Mortalité à 30 jours |
|---|---|
| 0 | 0,8 % |
| 1 | 1,6 % |
| 2 | 2,2 % |
| 3 | 4,4 % |
| 4 | 7,3 % |
| 5 | 12,4 % |
| 6 | 16,1 % |
| 7 | 23,4 % |
| 8 | 26,8 % |
| 9-14 | 35,9 % |
Prise en charge des patients atteints de STEMI
La prise en charge est une course contre la montre. L’objectif est double : prévenir la mort subite rythmique et limiter la taille de la nécrose par une reperfusion immédiate.
La phase préhospitalière
Le délai préhospitalier est le principal déterminant de la mortalité. Les patients doivent appeler le centre 15 (SAMU) et ne pas se rendre par leurs propres moyens aux urgences. Le diagnostic par ECG 12 dérivations sur les lieux permet l’activation directe de la salle de cathétérisme, évitant le passage aux urgences et réduisant le délai « Door-to-Balloon ». L’aspirine et le soulagement de la douleur sont initiés immédiatement. Si le délai de transport vers un centre d’angioplastie est estimé à > 120 minutes, une fibrinolyse préhospitalière doit être envisagée (stratégie pharmaco-invasive).
Le service des urgences
Si le patient arrive aux urgences, l’objectif est un délai « Door-to-ECG » < 10 minutes. Une fois le STEMI confirmé, l'équipe de cardiologie interventionnelle est activée immédiatement. Le traitement médical adjuvant est administré en parallèle de la préparation au transfert vers le laboratoire de cathétérisme.
Traitements médicamenteux de l’infarctus du myocarde avec sus-décalage du segment ST
Oxygène
L’oxygène doit être administré uniquement si la saturation (SpO2) est < 90 % ou en cas de détresse respiratoire.
L’hyperoxie peut entraîner une vasoconstriction coronaire et augmenter la production de radicaux libres, potentiellement aggravant les lésions de reperfusion. L’oxygène systématique n’est donc plus recommandé chez le patient normoxique.
Analgésie et sédation
Morphine
La morphine IV (2 à 5 mg) est l’analgésique de choix pour la douleur résistante aux nitrés.
Elle réduit l’anxiété et la douleur, diminuant ainsi la décharge sympathique et la consommation d’oxygène du myocarde. Cependant, la morphine ralentit le péristaltisme gastrique, ce qui peut retarder l’absorption et l’action des antiplaquettaires oraux (clopidogrel, ticagrelor, prasugrel). C’est pourquoi elle doit être utilisée avec discernement, uniquement pour les douleurs sévères persistantes.
Dérivés nitrés
Nitroglycérine
Indiqués pour soulager la douleur ischémique et traiter l’hypertension ou l’œdème pulmonaire. Contre-indiqués en cas d’hypotension (PAS < 90 mmHg), de bradycardie sévère, d'infarctus du ventricule droit (risque de collapsus par diminution de la précharge) ou de prise récente d'inhibiteurs de la phosphodiestérase-5 (Sildenafil/Viagra dans les 24h, Tadalafil dans les 48h).
Bêta-bloquants
Indications et Précautions
Les bêta-bloquants oraux doivent être initiés dans les 24 premières heures chez les patients stables (sans signes d’insuffisance cardiaque, sans risque de choc cardiogénique, sans bloc AV). Ils réduisent la demande en oxygène et le risque de fibrillation ventriculaire. L’administration IV précoce est réservée aux patients hypertendus sans signes d’insuffisance cardiaque, mais doit être évitée chez ceux à risque de choc (âge > 70 ans, FC > 110 bpm, PAS < 120 mmHg). L'étude REDUCE-AMI (2024) a récemment questionné l'utilité des bêta-bloquants au long cours chez les patients avec FEVG préservée, suggérant que le bénéfice est surtout marqué chez ceux avec dysfonction ventriculaire gauche.
Traitement antithrombotique
L’inhibition plaquettaire et la coagulation est essentielle pour préparer l’ICP et prévenir la thrombose de stent.
Aspirine (AAS)
Dose de charge : 160-320 mg à croquer (non enrobée) ou IV. Dose d’entretien : 75-100 mg/jour à vie.
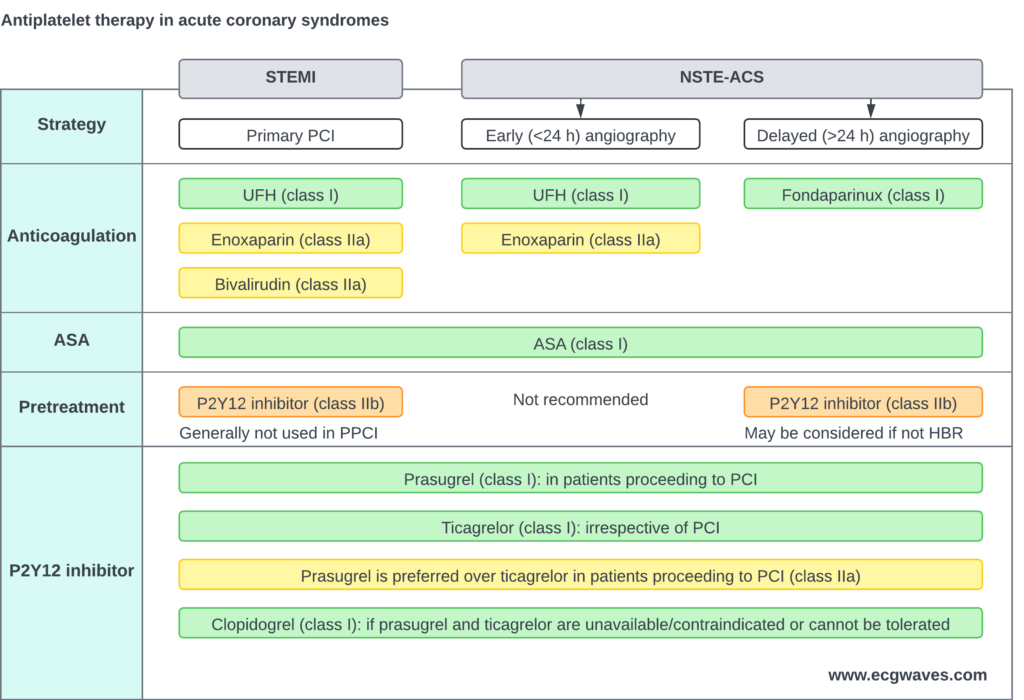
Inhibiteurs des récepteurs P2Y12 (Double Antiagrégation Plaquettaire – DAPT)
Le Prasugrel et le Ticagrelor sont préférés au Clopidogrel pour leur action plus rapide et plus puissante.
- Prasugrel : Dose de charge 60 mg. Préféré chez les patients naïfs d’inhibiteurs P2Y12 allant à l’ICP (étude ISAR-REACT 5). Contre-indiqué si antécédent d’AVC/AIT.
- Ticagrelor : Dose de charge 180 mg. Peut être utilisé quel que soit le prétraitement ou l’anatomie coronaire. Risque de dyspnée transitoire.
- Clopidogrel : Dose de charge 600 mg. Réservé aux patients avec contre-indication aux nouveaux agents, sous thrombolyse (dose de charge 300 mg si <75 ans), ou nécessitant une anticoagulation orale concomitante.
Anticoagulants parentéraux
Indispensables lors de l’ICP pour prévenir la thrombose du cathéter et du matériel.
- Héparine non fractionnée (HNF) : Standard de soins (70-100 UI/kg IV). Facile à surveiller (ACT) et réversible.
- Enoxaparine (HBPM) : Alternative possible, notamment si débutée en préhospitalier (0.5 mg/kg IV).
- Bivalirudine : Inhibiteur direct de la thrombine. Peut être envisagée pour réduire le risque hémorragique, notamment chez les patients avec antécédent de TIH.
Traitements adjuvants et prévention secondaire précoce
Statines à haute intensité
Une statine à forte dose (ex: Atorvastatine 80 mg ou Rosuvastatine 20 mg) doit être initiée dès l’admission, quel que soit le taux de cholestérol initial. Outre la réduction du LDL, elles possèdent des effets pléiotropes (stabilisation de la plaque, anti-inflammatoire) bénéfiques en phase aiguë.
Inhibiteurs du SRAA (IEC ou ARA II)
Les Inhibiteurs de l’Enzyme de Conversion (IEC) doivent être débutés dans les 24h chez les patients avec infarctus antérieur, insuffisance cardiaque, ou FEVG ≤ 40%, en l’absence d’hypotension. Ils préviennent le remodelage ventriculaire défavorable.
Reperfusion : ICP et fibrinolyse
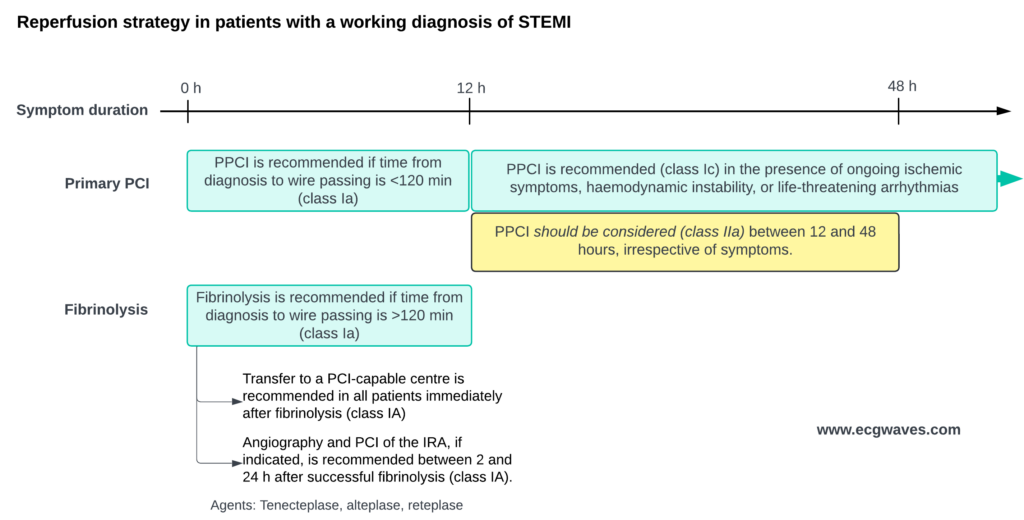
Le choix de la méthode dépend du délai estimé pour réaliser l’ICP :
- ICP Primaire (Angioplastie) : Méthode de choix si réalisable dans les 120 minutes suivant le diagnostic (« FMC-to-Wire »). Elle assure un taux de perméabilité supérieur (TIMI 3) et moins de complications hémorragiques (notamment cérébrales) que la fibrinolyse.
- Fibrinolyse (Thrombolyse) : Indiquée si l’ICP ne peut être réalisée dans les 120 minutes. Elle doit être administrée dans les 10 minutes suivant le diagnostic (« Needle time »). Après fibrinolyse, le patient doit être transféré immédiatement vers un centre d’ICP. En cas de succès (résolution du sus-décalage > 50%), une angiographie est réalisée dans les 2 à 24 heures (stratégie pharmaco-invasive). En cas d’échec, une ICP de sauvetage est requise immédiatement.
Intervention coronarienne percutanée (ICP)
La voie radiale est privilégiée pour réduire les saignements au point de ponction. L’implantation de stents actifs (DES) est la norme. En cas de thrombus massif, la thromboaspiration peut être utilisée en « bail-out » mais n’est plus recommandée systématiquement.
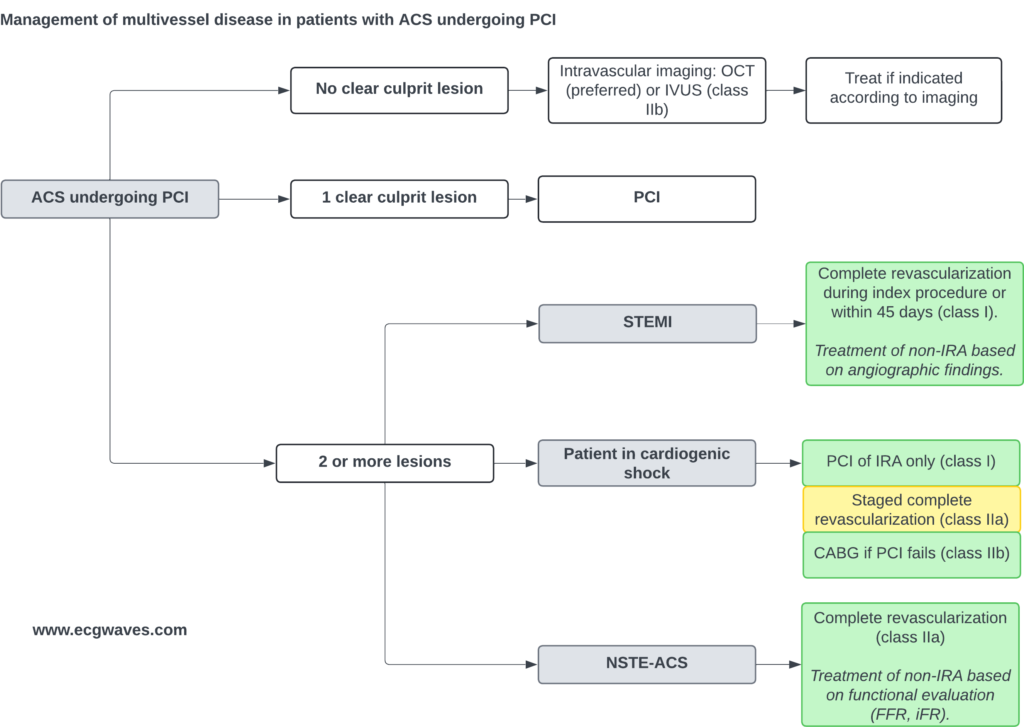
Prise en charge de la maladie multivasculaire
Environ 50% des patients avec STEMI ont une maladie multivasculaire. Les preuves actuelles (études COMPLETE, etc.) soutiennent une stratégie de revascularisation complète. Celle-ci peut être réalisée au cours de la procédure index (si le patient est stable et la procédure simple) ou, plus communément, par étapes (staged PCI) avant la sortie de l’hôpital (recommandation de classe I). Seul le choc cardiogénique fait exception : dans ce cas, seule l’artère coupable (Culprit lesion) doit être traitée en phase aiguë pour minimiser le trauma procédural (étude CULPRIT-SHOCK).
Références
1. Ducas, J., et al. “Outcomes of a Pre-Hospital Diagnosis and Catheter Laboratory Activation Program for ST Elevation Myocardial Infarction” Journal of the American College of Cardiology, vol. 53, no. 4, 2009, pp. 246-252.
2. Mencl, F., et al. “EMS Provider and Physician Interpretation of Electrocardiograms in ST-Elevation Myocardial Infarction” Prehospital Emergency Care, vol. 16, no. 3, 2012, pp. 378-382.
3. Sgarbossa, E. B., et al. “Electrocardiographic Diagnosis of Evolving Acute Myocardial Infarction in the Presence of Left Bundle-Branch Block” The New England Journal of Medicine, vol. 334, no. 8, 1996, pp. 481-487.
4. Smith, S. W., et al. “Diagnosis of ST-Elevation Myocardial Infarction in the Presence of Left Bundle Branch Block with the ST-Elevation to S-Wave Ratio in a Modified Sgarbossa Rule” Annals of Emergency Medicine, vol. 60, no. 6, 2012, pp. 766-776.
5. Byrne, R. A., et al. « 2023 ESC Guidelines for the management of acute coronary syndromes » European Heart Journal, vol. 44, no. 38, 2023, pp. 3720–3826.
6. Bangalore, S., et al. “β-Blocker Use and Clinical Outcomes in Stable Outpatients with and without Coronary Artery Disease” JAMA, vol. 308, no. 13, 2012, pp. 1340-1349.
7. O’Gara, P. T., et al. « 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction : Executive Summary » Journal of the American College of Cardiology, vol. 61, no. 4, 2013, pp. 485-510.
8. Yndigegn, T., et al. « Beta-Blockers after Myocardial Infarction and Preserved Ejection Fraction (REDUCE-AMI) » New England Journal of Medicine, 2024.
9. Schüpke, S., et al. « Ticagrelor or Prasugrel in Patients with Acute Coronary Syndromes (ISAR-REACT 5) » The New England Journal of Medicine, vol. 381, no. 16, 2019, pp. 1524-1534.
10. Thygesen, K., Alpert, J. S., Jaffe, A. S., Chaitman, B. R., Bax, J. J., Morrow, D. A., & White, H. D. (2018). Quatrième définition universelle de l’infarctus du myocarde (2018). Circulation, 138(20), e618-e651.
11. Reed, G. W., Rossi, J. E. et Cannon, C. P. (2017). L’infarctus aigu du myocarde. The Lancet, 389(10065), 197-210.