Bloc de branche gauche (BBG) : Critères ECG, causes, prise en charge
Bloc de branche gauche (BBG)
- Le système de conduction cardiaque
- Critères ECG pour le bloc de branche gauche (BBG)
- Électrophysiologie du bloc de branche gauche (BBG)
- Étiologies du bloc de branche gauche
- Implications cliniques et pronostic
- Diagnostic de l’ischémie myocardique aiguë et de l’infarctus chez les patients présentant un bloc de branche gauche (BBG)
- Diagnostic différentiel
- Prise en charge et Thérapie de Resynchronisation (CRT)
- Bloc de branche gauche incomplet
Le bloc de branche gauche (BBG) résulte d’une atteinte anatomique ou fonctionnelle de la branche gauche du faisceau de His, entraînant un blocage complet ou quasi-complet de la conduction de l’influx électrique à travers ce faisceau. Par conséquent, la séquence d’activation ventriculaire est profondément modifiée : la dépolarisation du ventricule gauche ne se fait plus par les voies de conduction rapides, mais est obtenue par des impulsions se propageant de proche en proche à travers le myocarde à partir du ventricule droit. L’impulsion électrique se propage dans le ventricule gauche partiellement ou entièrement en dehors du système de conduction spécialisé. Cette conduction myocytaire, beaucoup plus lente que la conduction hisienne, entraîne un élargissement significatif du complexe QRS. Le BBG se caractérise par une durée du QRS ≥ 0,12 seconde, une onde S profonde et large dans les dérivations précordiales droites (V1 et V2), et une onde R large, monophasique et souvent encochée dans les dérivations latérales (V5, V6, I et aVL).
Sur le plan hémodynamique, cette anomalie électrique engendre une asynchronisme de contraction mécanique (dyssynchronie interventriculaire et intraventriculaire), le septum se contractant bien avant la paroi latérale du ventricule gauche, ce qui peut altérer la fonction systolique globale.
La figure 1 (25 mm/s) illustre les différences morphologiques entre une conduction normale, un bloc de branche gauche (BBG) et un bloc de branche droit (BBD).
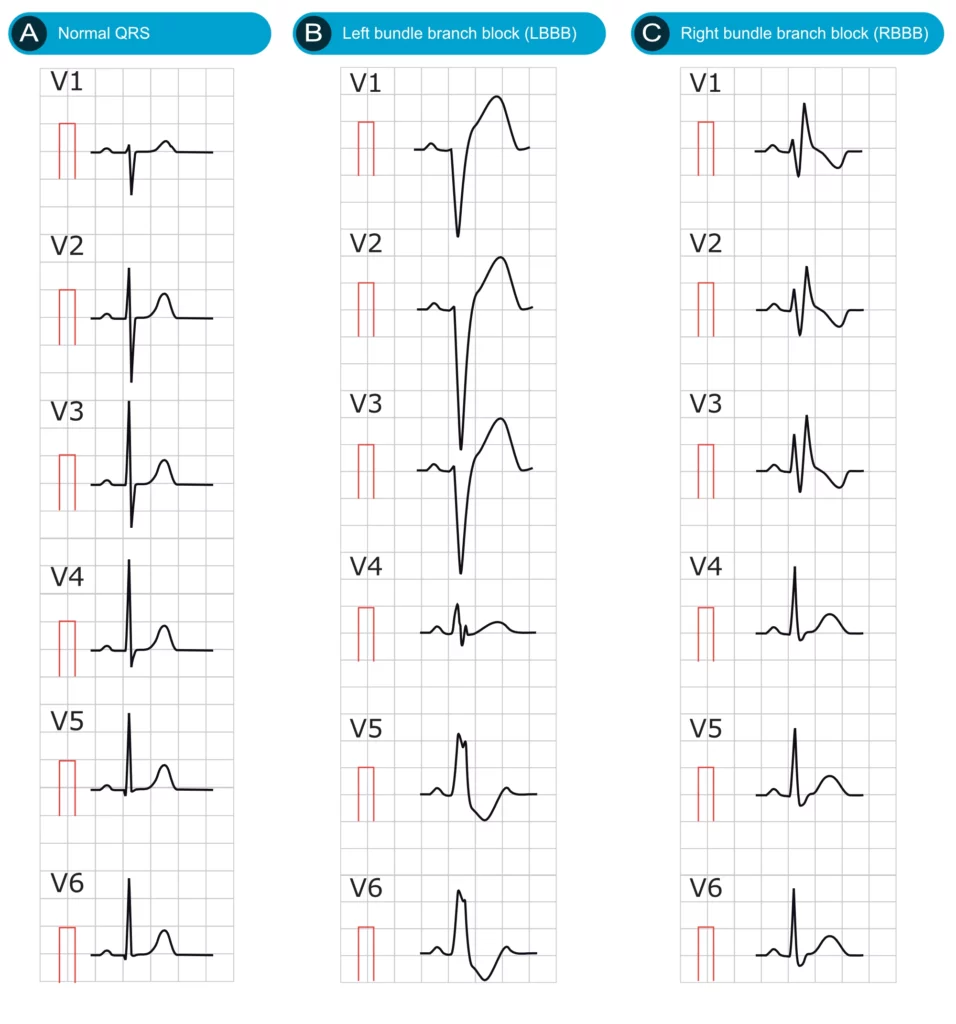
La figure 2 montre des électrocardiogrammes à 12 dérivations montrant des blocs de branche droit et gauche complets, permettant de visualiser l’ensemble des dérivations frontales et précordiales.
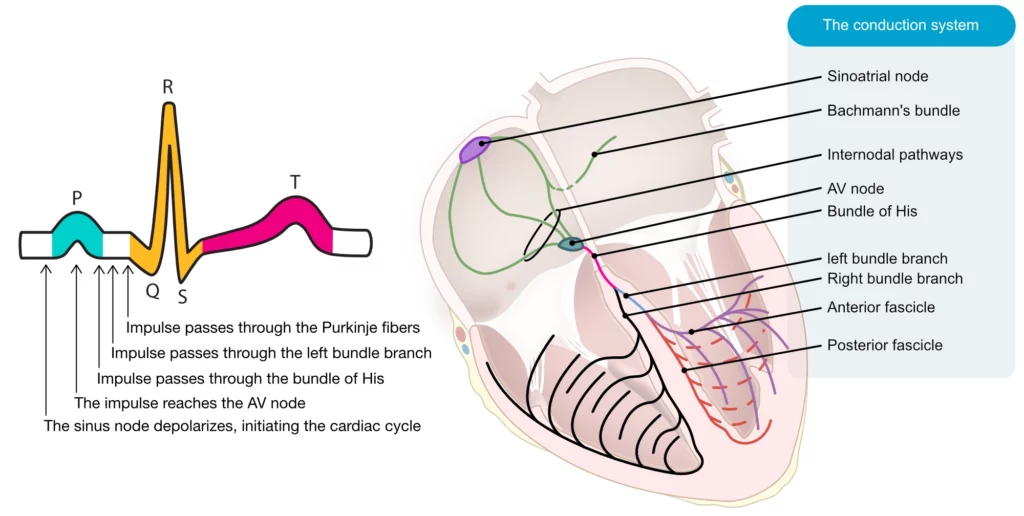
Le système de conduction cardiaque
Le système de conduction cardiaque assure une propagation rapide et synchronisée de la dépolarisation, ce qui est essentiel pour une activité auriculaire et ventriculaire coordonnée et efficace. Le système de conduction comprend le nœud sinusal (SA), le nœud auriculo-ventriculaire (AV), le faisceau de His, les branches du faisceau (gauche et droite) et les fibres de Purkinje. Le système de conduction permet une propagation rapide de la dépolarisation vers les cellules contractiles. La figure 3 illustre les composants du système de conduction et leur relation temporelle avec les formes d’ondes de l’ECG. Le cycle cardiaque commence dans le nœud sinusal, où la dépolarisation se produit par automatisme (voir Électrophysiologie cardiaque). L’impulsion électrique se propage dans les oreillettes via les voies internodales et le faisceau de Bachmann, pour finalement atteindre le nœud auriculo-ventriculaire (AV). Ici, la conduction est brièvement retardée pour permettre un remplissage ventriculaire adéquat. L’impulsion traverse ensuite le faisceau de His, qui se divise en deux branches : la branche gauche du faisceau et la branche droite du faisceau. La branche gauche du faisceau se divise en fascicules antérieur et postérieur (hémibranches). Les branches du faisceau et les fascicules jouent un rôle essentiel dans la diffusion de l’impulsion dans les ventricules. Un dysfonctionnement des branches du faisceau ou des fascicules entraîne des modifications caractéristiques de l’ECG, retardant l’activation de la zone tributaire de la branche bloquée.
Critères ECG pour le bloc de branche gauche (BBG)
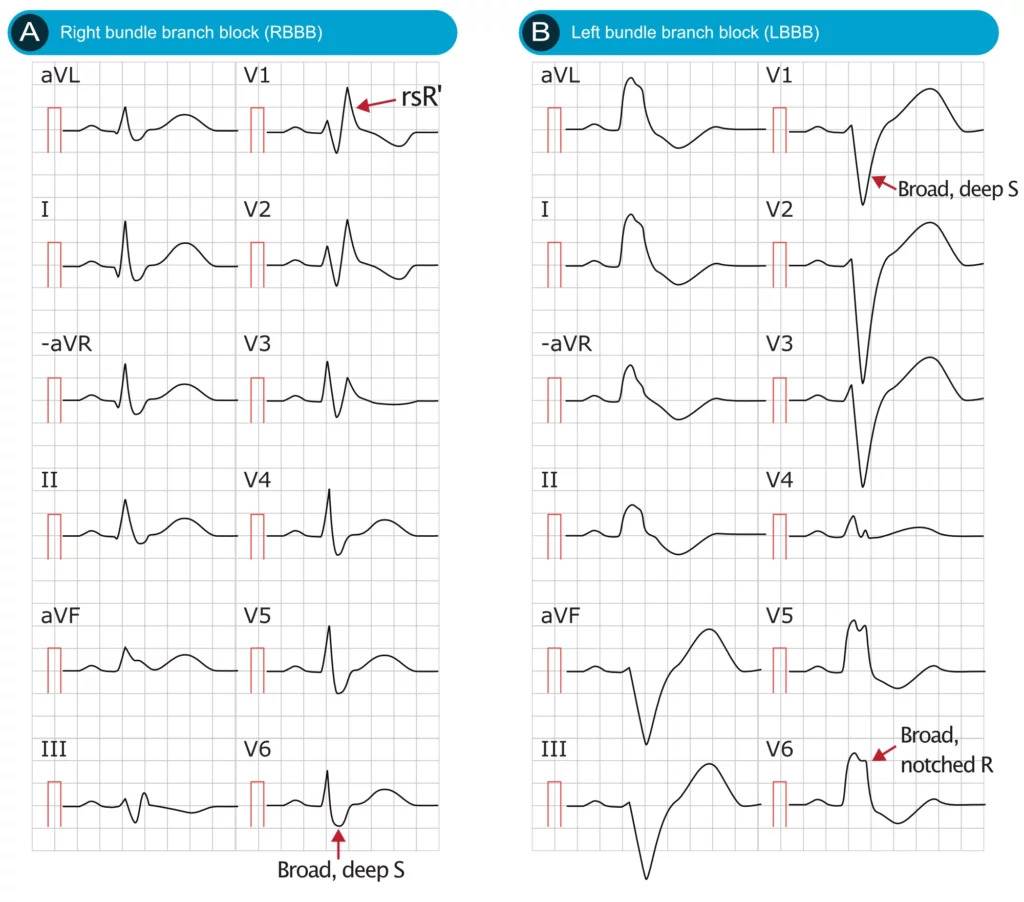
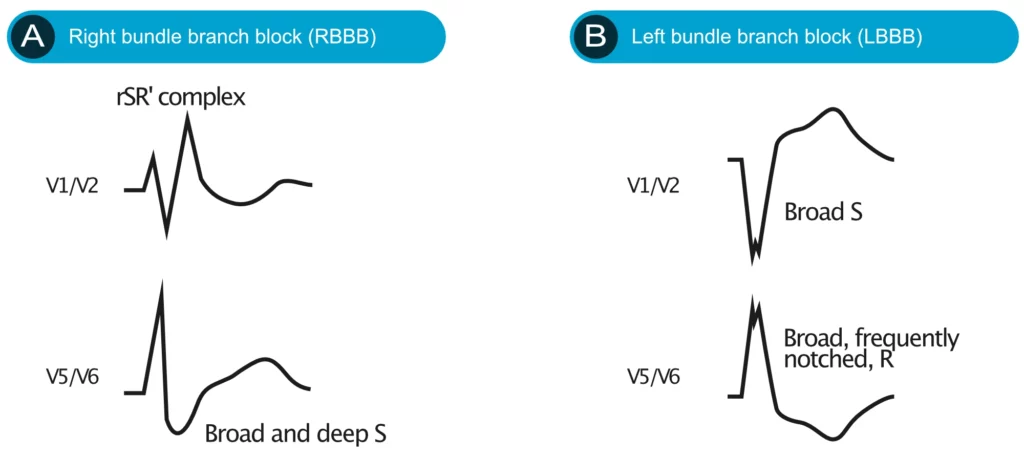
Le diagnostic du bloc de branche gauche est relativement simple mais doit être rigoureux. La caractéristique fondamentale du BBG est l’allongement de la durée du QRS dû à l’activation séquentielle (et non simultanée) des ventricules. Une durée de QRS de 120 ms (0,12 s) ou plus est nécessaire pour diagnostiquer un bloc de branche gauche complet. Outre la durée prolongée du QRS, le BBG se caractérise par des ondes S profondes et larges dans les dérivations V1 et V2 et des ondes R larges, souvent encochées, dans les dérivations V5 et V6. Des modifications ST-T secondaires se produisent invariablement en présence d’un BBG, phénomène connu sous le nom de discordance appropriée. Les critères et caractéristiques ECG suivants sont utilisés pour diagnostiquer le BBG :
- Durée du QRS ≥ 0,12 seconde (souvent > 140 ms en cas de pathologie structurelle sévère).
- Dérivations V1-V2 : onde S profonde et large. La petite onde r initiale est généralement absente ou très petite ; si elle est absente, un complexe QS apparaît en V1 et parfois en V2, mais rarement en V3.
- L’onde S dans V1 peut être encochée et ressembler à la lettre W (bien que cela soit moins spécifique que l’aspect en M du BBD).
- Dérivations V5-V6 : onde R large, complètement positive, monophasique et souvent encochée ou crochetée au sommet. Absence d’onde q septale (les ondes q sont absentes en I, V5 et V6).
- Temps d’inscription de la déflexion intrinsécoïde : Il est retardé et dépasse 60 ms dans les dérivations précordiales gauches (V5, V6), reflétant le retard d’activation de la paroi libre du ventricule gauche.
- Dérivations I et aVL : semblables à V5 et V6, montrant un aspect R exclusif ou Rs sans onde q initiale.
- Modifications du segment ST-T (Discordance appropriée) : Les complexes QRS et les ondes T sont typiquement discordants. Les dérivations gauches (V5, V6, I et aVL) avec des ondes R positives présentent des inversions de l’onde T et des dépressions du segment ST (sous-décalage). Les dérivations V1-V3 avec des ondes S profondes présentent une élévation du segment ST (sus-décalage concave vers le haut) et des ondes T positives. L’élévation du segment ST dépasse rarement 5 mm dans les cas non ischémiques, mais peut être proportionnelle à la profondeur de l’onde S.
Il est important de souligner que la présence d’ondes Q pathologiques dans les dérivations latérales suggère une pathologie sous-jacente autre que le simple bloc de branche, souvent une cicatrice d’infarctus ou une cardiomyopathie sévère, car le BBG supprime normalement les ondes Q septales physiologiques.
La figure 4 illustre les caractéristiques distinctives de la BBD et de la BBG.
Électrophysiologie du bloc de branche gauche (BBG)
La compréhension des vecteurs est cruciale pour interpréter le BBG. La dépolarisation ventriculaire commence normalement dans le septum interventriculaire à mi-hauteur, qui reçoit les fibres de Purkinje de la branche gauche du faisceau. Par conséquent, la dépolarisation normale du septum commence dans sa partie gauche et progresse vers sa partie droite (vecteur septal dirigé vers la droite et l’avant). La dépolarisation du septum génère ainsi les petites ondes r observées dans les dérivations V1 et V2, ainsi que les petites ondes q observées dans les dérivations V5 et V6, communément appelées “ondes q septales”. Ces schémas normaux sont illustrés dans la figure 5.
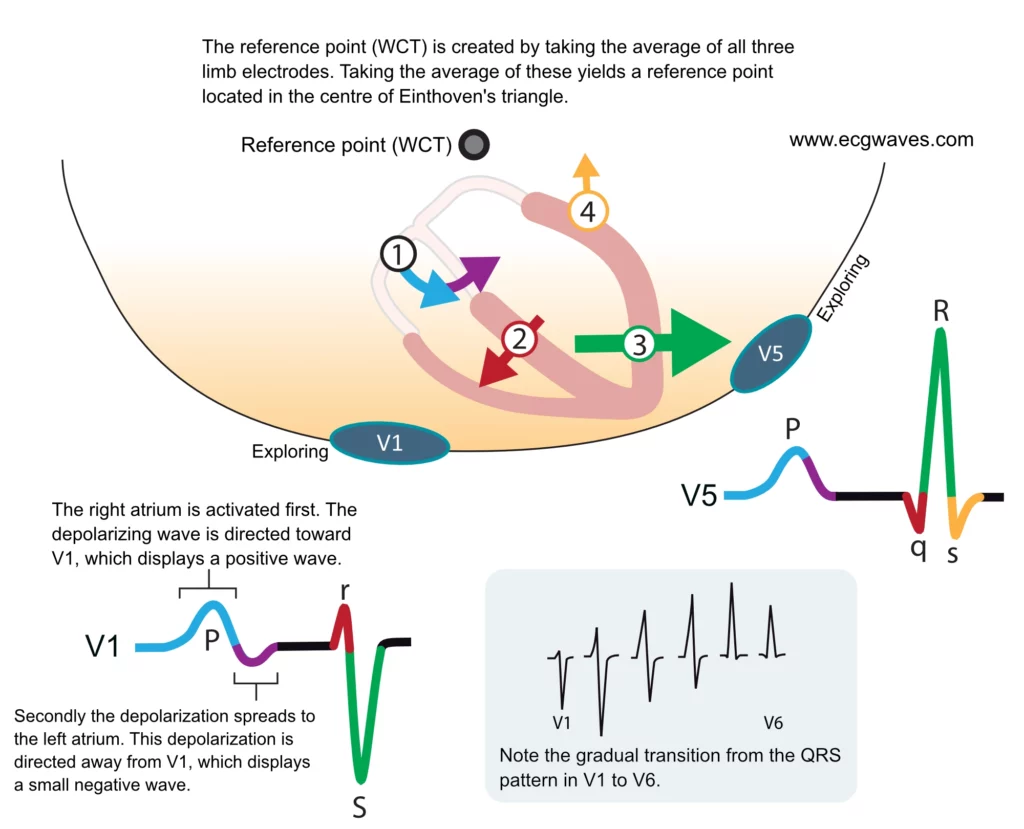
En cas de bloc de branche gauche, l’activation septale normale (gauche vers droite) est perdue. La dépolarisation du septum se produit par le biais d’impulsions se propageant à partir du ventricule droit (activé par la branche droite intacte), se dirigeant donc de la droite vers la gauche. Par conséquent, les petites ondes r dans V1-V2 et les petites ondes q dans V5-V6 sont soit diminuées, soit disparues (remplacées par des ondes R pures). La dépolarisation se poursuit lentement vers la paroi libre du ventricule gauche et le vecteur est continuellement dirigé vers la gauche et l’arrière. Cela provoque une onde S large dans V1-V2 (appelée complexe QS si l’onde r est absente) et une onde R large et encochée dans V5-V6.
En raison de la séquence de dépolarisation anormale du ventricule gauche dans le BBG, le processus de repolarisation est également anormal, ce qui entraîne des modifications ST-T secondaires qui deviennent apparentes. En cas de BBG, on s’attend à ce que des dépressions du segment ST et des inversions de l’onde T existent dans les dérivations gauches (V5, V6, I et aVL). Simultanément, les dérivations V1-V3 présentent typiquement une élévation du segment ST et des ondes T positives. C’est le principe de la discordance : le segment ST et l’onde T vont dans le sens opposé au complexe QRS.
Axe électrique dans le bloc de branche gauche (BBG)
L’axe électrique peut être inchangé ou dévier vers la gauche ou (rarement) vers la droite. Bien que le BBG seul puisse entraîner une déviation axiale gauche modérée, une déviation de l’axe gauche marquée (au-delà de -30°) suggère souvent une maladie de conduction plus étendue ou une atteinte structurelle significative. Une déviation axiale droite en présence d’un BBG est très rare et doit faire évoquer une hypertrophie ventriculaire droite associée ou une cardiomyopathie dilatée congestive sévère.
Étiologies du bloc de branche gauche
Contrairement au bloc de branche droit, qui peut parfois être observé chez des individus sains, le bloc de branche gauche est presque toujours le témoin d’une cardiopathie sous-jacente. Les étiologies peuvent être classées en causes structurelles et fonctionnelles.
- Causes dégénératives et ischémiques : L’hypertension artérielle de longue date (avec hypertrophie ventriculaire gauche) et la maladie coronarienne (cardiopathie ischémique chronique ou infarctus aigu) sont les causes les plus fréquentes. La fibrose du système de conduction (maladie de Lenègre ou de Lev) est fréquente chez le sujet âgé.
- Cardiomyopathies : Le BBG est très fréquent (jusqu’à 30%) dans les cardiomyopathies dilatées primitives ou secondaires.
- Valvulopathies : La sténose aortique (rétrécissement aortique calcifié) est une cause classique, les calcifications pouvant s’étendre au système de conduction adjacent.
- Causes inflammatoires et infiltratives : Myocardites, sarcoïdose cardiaque, amylose.
- Causes toxiques et métaboliques : L’hyperkaliémie sévère ou l’intoxication aux antiarythmiques de classe I (qui ralentissent la conduction) peuvent élargir le QRS et mimer un BBG (bloc intraventriculaire non spécifique).
Implications cliniques et pronostic
Le bloc de branche gauche est toujours une découverte pathologique et possède une valeur pronostique indépendante. Il affecte la contractilité du ventricule gauche (fonction systolique) en induisant une dyssynchronie ventriculaire. Cette dyssynchronie réduit l’efficacité de la pompe cardiaque, augmente la consommation d’oxygène du myocarde et favorise le remodelage ventriculaire défavorable.
Le BBG est fortement associé à l’hypertension, à l’hypertrophie ventriculaire gauche, à la sténose aortique, à la régurgitation aortique, à la myocardite, à la cardiopathie ischémique, à l’insuffisance cardiaque et aux cardiomyopathies. L’étude Framingham Heart Study a montré que l’apparition d’un bloc de branche gauche était associée à un risque sept fois plus élevé d’insuffisance cardiaque, à un risque deux fois plus élevé de maladie coronarienne et à un risque significativement plus élevé de mortalité cardiovasculaire (Schneider et al.). Le bloc de branche gauche est rare chez les jeunes (< 0,5 %) et sa prévalence augmente considérablement avec l'âge.
Diagnostic de l’ischémie myocardique aiguë et de l’infarctus chez les patients présentant un bloc de branche gauche (BBG)
Dans le BBG, l’activation du ventricule gauche repose sur des impulsions électriques se propageant à partir du ventricule droit, ce qui entraîne une dépolarisation lente et anormale du ventricule gauche. Cette dépolarisation anormale produit un complexe QRS atypique (voir plus haut). En outre, la repolarisation anormale entraîne des modifications secondaires du segment ST-T, notamment des élévations du segment ST dans les dérivations V1-V3, des dépressions du segment ST dans les dérivations V4, V5, V6, aVL et I, ainsi que des ondes T inversées dans les dérivations présentant des dépressions du segment ST. Ces modifications du segment ST-T sont normales et attendues en présence d’un BBG. Toutefois, la perturbation électrique sous-jacente et les modifications secondaires du segment ST-T qui lui sont associées posent un problème important pour le diagnostic de l’ischémie aiguë. Les directives actuelles de la Société européenne de cardiologie (ESC), de l’American Heart Association (AHA) et de l’American College of Cardiology (ACC) déconseillent d’utiliser les critères ECG standard pour diagnostiquer un infarctus aigu du myocarde en présence d’un BBG. La figure 6 montre les élévations et les dépressions typiques du segment ST observées chez un patient asymptomatique présentant un BBG.
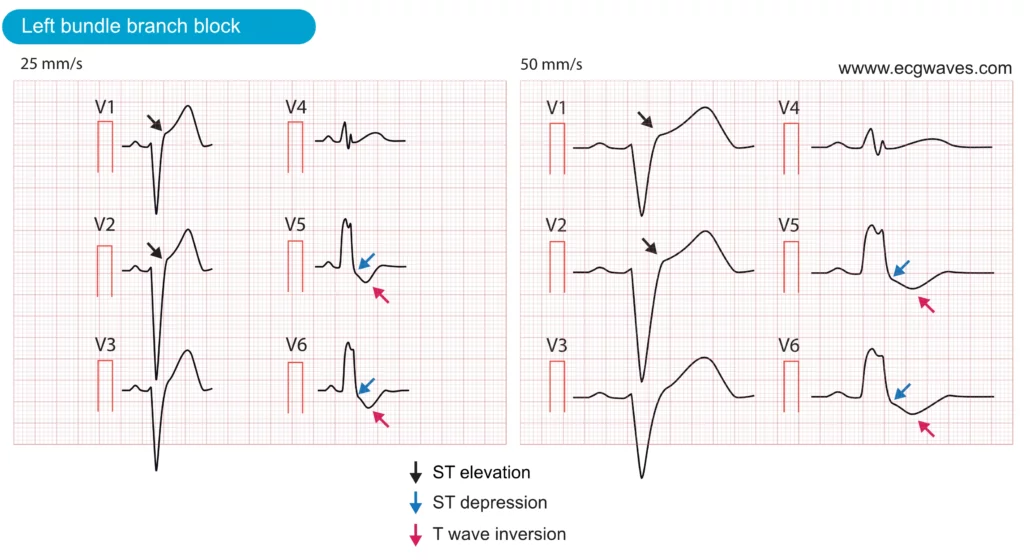
Le BBG complique l’évaluation des patients suspects d’infarctus aigu du myocarde pour trois raisons :
- Le bloc de branche gauche (BBG) peut imiter l’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI), car il se présente souvent avec des modifications similaires de l’ECG, notamment des élévations et des dépressions du segment ST et des inversions de l’onde T. Ces caractéristiques superposées entraînent souvent une confusion entre le BBG et l’infarctus aigu du myocarde avec sus-décalage du segment ST (faux positifs).
- Le BBG peut masquer une ischémie myocardique en cours : le BBG provoque une perturbation prononcée de la repolarisation ventriculaire, ce qui empêche généralement d’autres modifications ST-T (telles que celles résultant de l’ischémie) de s’exprimer sur l’ECG. Par conséquent, les modifications ischémiques du segment ST (élévations ST, dépressions ST, modifications de l’onde T) sont généralement dissimulées dans le cadre du BBG (faux négatifs). Un patient souffrant d’un infarctus aigu du myocarde avec sus-décalage du segment ST peut donc présenter un BBG « normal ».
- Le BBG peut être causé par une ischémie ou un infarctus : un infarctus aigu du myocarde (en particulier un STEMI antérieur proximal) peut provoquer un BBG « de novo ». Un infarctus aigu du myocarde peut donc entraîner un BBG, qui dissimule alors les modifications ischémiques du segment ST-T sur l’ECG.
En résumé, le BBG peut résulter d’une ischémie myocardique aiguë ou d’un infarctus, les imiter ou les dissimuler, ce qui pose des problèmes diagnostiques considérables. C’est pourquoi des chercheurs ont décidé d’examiner les patients présentant un BBG et suspectés d’infarctus aigu du myocarde (IAM) en les orientant vers un traitement de reperfusion urgent, ce qui équivalait à l’époque à une fibrinolyse (Wilner et al.). Leurs conclusions ont montré qu’une proportion significative de ces patients présentait une occlusion complète de l’artère coronaire et que leur état s’améliorait lorsqu’ils étaient pris en charge comme des cas d’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI).
Pendant près de vingt ans, les lignes directrices européennes et nord-américaines ont recommandé de traiter les patients présentant des symptômes d’ischémie myocardique et un BBG nouveau (ou présumé nouveau) comme des cas d’infarctus aigu du myocarde avec sus-décalage du segment ST (STEMI). Cependant, un nombre croissant de preuves a démontré que cette approche entraînait un taux inacceptable d’angiographies inutiles, car la majorité des patients avec BBG et douleur thoracique n’ont pas d’occlusion coronaire aiguë. C’est pourquoi les lignes directrices indiquent désormais que le BBG nouveau (ou présumé nouveau) ne doit pas être utilisé isolément comme critère diagnostique de l’infarctus aigu du myocarde (O’Gara et al.). Au lieu de cela, les patients ayant une forte suspicion clinique d’ischémie myocardique en cours – indépendamment de l’ECG – devraient recevoir un traitement similaire à celui des patients présentant un STEMI clair. Cette approche s’applique particulièrement aux patients qui restent symptomatiques malgré un traitement médical initial, qui sont hémodynamiquement instables ou qui développent des arythmies ventriculaires soutenues. De même, les lignes directrices 2023 de la Société européenne de cardiologie (ESC) recommandent de traiter les patients présentant un BBG ou un BBD et des signes ou symptômes indiquant fortement une ischémie myocardique en cours comme ayant un STEMI définitif, que le bloc de branche ait été ou non documenté précédemment (Byrne et al.).
Critères de Sgarbossa pour le diagnostic de l’ischémie aiguë en cas de BBG
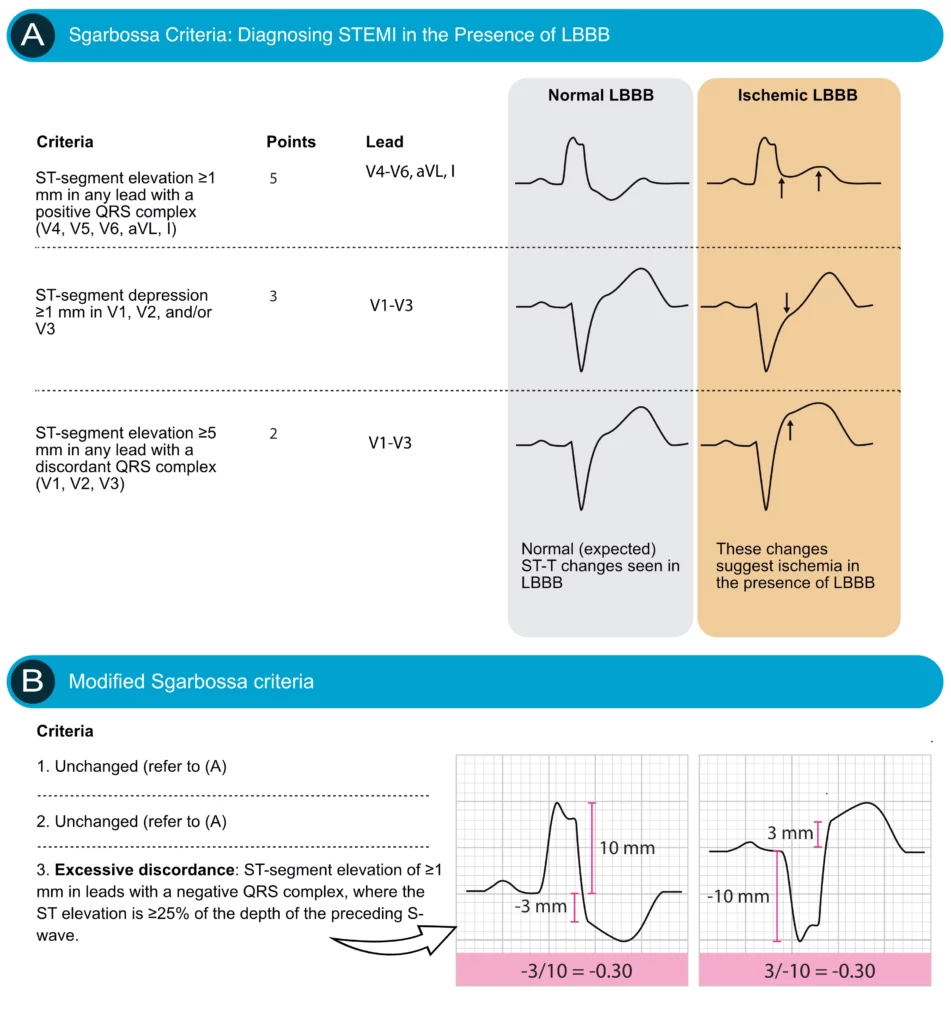
Plusieurs critères ECG ont été proposés pour diagnostiquer l’ischémie myocardique aiguë et l’infarctus dans le cadre d’un BBG, afin de repérer les signes de « discordance inappropriée ». Les critères les plus utiles sont les critères de Sgarbossa (Neeland et al.), qui ont été par la suite affinés par Smith (critères de Sgarbossa modifiés). Ces critères sont résumés dans la figure 7.
Les critères originaux de Sgarbossa attribuent des points aux anomalies suivantes :
- Critère A (5 points) : Élévation du segment ST ≥ 1 mm concordante avec le complexe QRS (c’est-à-dire dans une dérivation où le QRS est positif). Ce signe est très spécifique de l’infarctus.
- Critère B (3 points) : Dépression du segment ST ≥ 1 mm dans les dérivations V1, V2 ou V3 (dérivations où le QRS est normalement négatif). Ce signe est également très spécifique.
- Critère C (2 points) : Élévation du segment ST ≥ 5 mm discordante avec le complexe QRS (c’est-à-dire dans une dérivation où le QRS est négatif, typiquement V1-V3). Ce critère a une sensibilité plus faible.
Pour améliorer la précision diagnostique, les critères de Sgarbossa modifiés par Smith remplacent le critère C absolu par un ratio : une élévation du ST discordante est considérée comme pathologique si le rapport (amplitude ST / amplitude onde S) est inférieur à -0,25 (c’est-à-dire que le sus-décalage représente plus de 25% de la profondeur de l’onde S). Ces critères modifiés offrent une meilleure sensibilité tout en maintenant une excellente spécificité.
Pour une discussion détaillée, voir BBG et infarctus aigu du myocarde. En résumé, aucun critère existant n’est suffisamment sensible pour détecter de manière fiable l’infarctus aigu du myocarde à 100%. L’évaluation des symptômes, de l’état hémodynamique et des autres signes d’ischémie est beaucoup plus utile pour orienter les décisions thérapeutiques.
Diagnostic différentiel
Plusieurs entités peuvent présenter une morphologie similaire au BBG sur l’ECG et doivent être distinguées :
- Hypertrophie ventriculaire gauche (HVG) : Elle se caractérise par une augmentation de la masse du ventricule gauche. Cette augmentation de la masse musculaire peut entraîner une légère prolongation de la dépolarisation et de la repolarisation, conduisant à une légère augmentation de la durée du QRS ; cependant, elle n’atteint ou ne dépasse généralement pas 0,12 seconde. En outre, la morphologie du QRS dans l’HVG peut également ressembler à celle du bloc de branche gauche (BBG) (en particulier le bloc de branche gauche incomplet). Il est généralement facile de faire la distinction entre les deux. Dans l’HVG, les ondes q septales (V5, V6, aVL et I) sont préservées (ou amplifiées) et le complexe QRS a une très grande amplitude. Dans le BBG, la durée du QRS est d’au moins 0,12 seconde. Bien entendu, le BBG et l’HVG peuvent s’accompagner l’un de l’autre.
- Stimulation ventriculaire droite (Pacemaker) : La stimulation artificielle du ventricule droit (par une sonde de pacemaker) crée une séquence d’activation qui part de l’apex ou du septum droit vers le ventricule gauche. Cela mime presque parfaitement un BBG (aspect QS en V1, R large en V6). La présence de spikes (artefacts de stimulation) devant le QRS permet le diagnostic.
- Syndrome de Wolff-Parkinson-White (WPW) : Certaines voies accessoires droites (Type B) peuvent produire une pré-excitation avec une onde delta négative en V1 et positive en V6, simulant un aspect de BBG. L’intervalle PR court est la clé du diagnostic différentiel.
Prise en charge et Thérapie de Resynchronisation (CRT)
La découverte d’un BBG nécessite toujours un bilan cardiaque complet, incluant au minimum une échocardiographie pour évaluer la structure et la fonction cardiaque. Chez les patients souffrant d’insuffisance cardiaque avec fraction d’éjection réduite (HFrEF), le BBG joue un rôle central dans la stratégie thérapeutique.
Comme mentionné précédemment, le BBG induit une dyssynchronie électromécanique qui aggrave l’insuffisance cardiaque. La Thérapie de Resynchronisation Cardiaque (CRT), qui consiste à stimuler simultanément les deux ventricules (stimulation biventriculaire) pour restaurer une contraction synchronisée, est particulièrement efficace chez ces patients.
Selon les recommandations internationales (ESC/AHA), la CRT est indiquée (Classe I) chez les patients présentant :
- Un rythme sinusal.
- Une fraction d’éjection du ventricule gauche (FEVG) ≤ 35 %.
- Des symptômes d’insuffisance cardiaque persistants (NYHA II, III ou IV ambulatoire) malgré un traitement médical optimal.
- Un bloc de branche gauche avec une durée de QRS ≥ 150 ms.
Pour les durées de QRS entre 130 et 149 ms avec morphologie de BBG, l’indication reste forte (Classe IIa). La correction du BBG par la resynchronisation entraîne souvent une amélioration spectaculaire de la fonction cardiaque, une réduction des hospitalisations et une baisse de la mortalité.
Bloc de branche gauche incomplet
Le bloc de branche gauche incomplet est moins fréquent que la forme complète et représente souvent un stade précoce de la maladie de conduction ou un signe d’HVG. Dans ce cas, la conduction à travers la branche gauche du faisceau est préservée mais se produit à une capacité réduite par rapport à une branche normale du faisceau. Ainsi, la dépolarisation initiale du ventricule gauche se produit par l’intermédiaire d’impulsions se propageant à partir du ventricule droit, mais après un certain temps, l’impulsion passe le bloc de la branche gauche du faisceau et exécute le reste de la dépolarisation ventriculaire normalement. Par conséquent, le complexe QRS initial ressemble à un bloc de branche gauche (BBG), mais la durée du QRS est inférieure à 0,12 seconde. Les blocs de branche gauche incomplets ont tendance à évoluer vers des blocs de branche complets.
- Durée du complexe QRS > 0,10 et < 0,12 seconde.
- Temps de culmination de l’onde R (déflexion intrinsécoïde) ≥ 0,06 seconde dans V5, V6.
- Absence d’onde q septale normale en V5, V6, I et aVL (critère essentiel).
- Branche ascendante entaillée de l’onde R dans V5, V6, aVL et I.