Bloc auriculo-ventriculaire (bloc AV) : définition, causes, diagnostic et prise en charge
Cet article traite des principes fondamentaux des blocs auriculo-ventriculaires (BAV), qui sont classés en trois types selon leur sévérité : blocs AV du premier degré, du deuxième degré et du troisième degré. Il s’agit d’une pathologie fréquente du système de conduction cardiaque, dont la gravité varie d’une simple anomalie électrocardiographique bénigne à une urgence vitale nécessitant une stimulation cardiaque immédiate. Les lecteurs déjà familiarisés avec les bases physiopathologiques des blocs AV peuvent passer directement aux chapitres suivants ou aux articles dédiés, qui fournissent des discussions détaillées et des tracés ECG pour chaque type.
Le système de conduction auriculo-ventriculaire (AV) et les blocs AV
Le système de conduction auriculo-ventriculaire (AV) est l’unique voie de transmission électrique physiologique entre les oreillettes et les ventricules. Il est composé du nœud AV (nœud d’Aschoff-Tawara) et du système de His-Purkinje. La conduction à travers le nœud AV est intentionnellement décrémentielle et lente (en raison de la faible concentration de jonctions gap et de la dépendance aux potentiels d’action calciques lents), ce qui permet au remplissage ventriculaire de se terminer avant la contraction ventriculaire (systole auriculaire) et protège le ventricule des fréquences auriculaires excessives (comme dans la fibrillation atriale). En revanche, les cellules contractiles – et les fibres de Purkinje en particulier – sont riches en jonctions lacunaires et dépendent des canaux sodiques rapides, ce qui permet une conduction véloce de l’impulsion dans les ventricules.
Sur le plan anatomique et vasculaire, il est crucial de noter que le nœud AV est vascularisé par l’artère du nœud AV, qui naît de l’artère coronaire droite dans environ 90 % des cas (dominance droite) et de l’artère circonflexe dans 10 % des cas. Le faisceau de His et ses branches ont une vascularisation double plus riche (artère coronaire droite et artères septales de l’interventriculaire antérieure), ce qui les rend plus résistants à l’ischémie, sauf en cas d’infarctus antérieur étendu ou de lésions pluritronculaires sévères.
Après avoir franchi le nœud AV, l’impulsion électrique traverse le faisceau de His, qui pénètre le squelette fibreux du cœur et se divise en deux branches, l’une gauche et l’autre droite. La branche gauche du faisceau se subdivise en deux fascicules (hémibranche antérieure et postérieure), et parfois un fascicule septal médian. À partir de ces branches et de ces faisceaux, les fibres de Purkinje s’étendent dans le myocarde. La conduction à travers le système de Purkinje est très rapide (2 à 4 m/s). Cette transmission garantit que la majorité du myocarde ventriculaire se dépolarise presque simultanément, de l’apex vers la base, maximisant ainsi l’efficacité hémodynamique (figure 1).
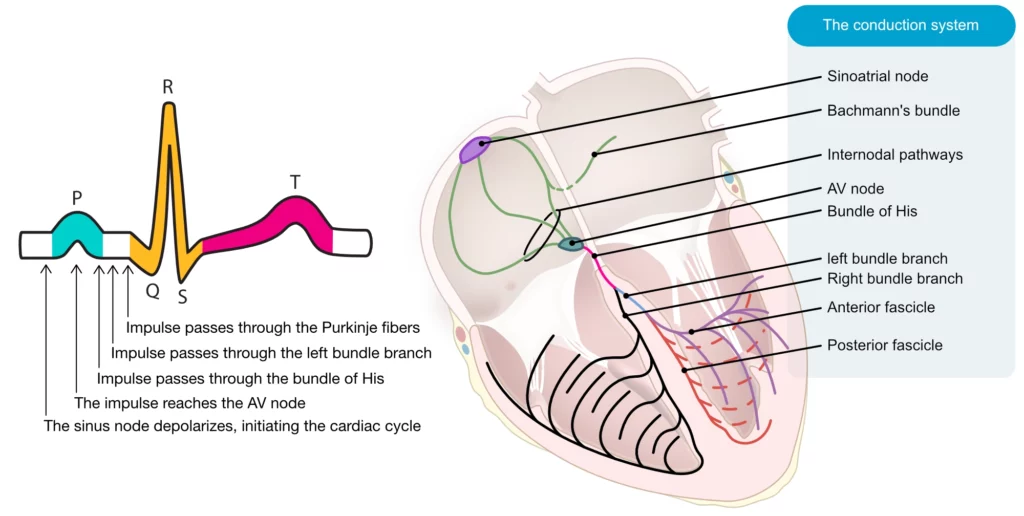
Le nœud auriculo-ventriculaire (AV) est densément innervé par le système nerveux autonome. La stimulation sympathique améliore la conduction (effet dromotrope positif) et l’excitabilité (effet bathmotrope positif). En revanche, la stimulation parasympathique (vagale) via l’acétylcholine augmente la période réfractaire et la résistance dans le nœud AV. Une activité parasympathique intense (« malaise vagal ») peut entraîner un blocage complet et transitoire de la conduction. Si ce blocage persiste, une asystolie survient jusqu’à l’émergence d’un rythme d’échappement ventriculaire ou jonctionnel.
Vue d’ensemble et classification des blocs AV
La conduction de l’influx des oreillettes vers les ventricules peut être retardée ou interrompue. On parle alors de bloc auriculo-ventriculaire (BAV). La classification traditionnelle repose sur l’analyse de l’électrocardiogramme de surface et permet de stratifier le risque clinique.
Bloc AV du premier degré
Synonymes : Bloc AV 1, bloc AV I
Il ne s’agit pas d’un véritable « bloc » (interruption), mais d’un allongement anormal du temps de conduction auriculo-ventriculaire. Par définition, l’intervalle PR est constant et > 0,20 s (ou 200 ms) chez l’adulte. Toutes les impulsions sinusales sont conduites aux ventricules (rapport 1:1). Le bloc AV du premier degré est le plus souvent nodal et bénin, mais un PR très long (> 0,30 s) peut entraîner une hémodynamique défavorable en amputant le temps de remplissage diastolique (syndrome du pacemaker pseudo-implanté), justifiant parfois une prise en charge.
Bloc AV du second degré
Synonymes : Bloc AV 2, bloc AV II
Dans le bloc AV du second degré, la conduction est intermittente : certaines ondes P sont bloquées et non suivies de QRS. On distingue deux types principaux aux pronostics très différents :
- Bloc AV du deuxième degré Type Mobitz 1 (Luciani-Wenckebach) : Caractérisé par un allongement progressif de l’intervalle PR jusqu’à ce qu’une onde P soit bloquée (phénomène de Wenckebach). L’intervalle PR suivant l’onde bloquée est plus court. Le siège est généralement nodal (supra-hisien) et le pronostic est bon, sauf s’il est symptomatique.
- Bloc AV du second degré de type Mobitz 2 : Blocage inopiné d’une onde P sans allongement préalable du PR. L’intervalle PR des battements conduits est constant (fixe). Le siège est presque toujours infranodal (His-Purkinje), témoignant d’une maladie structurelle du système de conduction, et le risque d’évolution vers un bloc complet (asystolie) est élevé. C’est une indication formelle de stimulation (classe I).
Le bloc de haut degré (ex: 2:1 ou 3:1) est une forme avancée où plusieurs ondes P consécutives peuvent être bloquées ou où la conduction se fait selon un ratio fixe (2 ondes P pour 1 QRS). Si le bloc 2:1 est difficile à classer (Mobitz 1 ou 2 car on ne voit pas l’évolution du PR), la largeur du QRS et les manœuvres vagales aident au diagnostic : un QRS fin oriente vers un Mobitz 1, un QRS large vers un Mobitz 2.
Bloc AV du troisième degré
Synonymes : bloc cardiaque complet, dissociation AV, bloc AV III, bloc AV 3
Il s’agit d’une interruption totale de la conduction AV. Aucune impulsion auriculaire n’atteint les ventricules. On observe une dissociation auriculo-ventriculaire complète : les oreillettes battent à leur propre rythme (sinusal, tachysystolie ou fibrillation) et les ventricules sont stimulés indépendamment par un rythme d’échappement (jonctionnel ou ventriculaire) plus lent. La gravité dépend de la fiabilité et de la fréquence de ce rythme d’échappement. Un échappement ventriculaire bas (complexes larges), lent (< 30-40 bpm) et instable engage le pronostic vital à court terme.
Tableau clinique et symptômes
La symptomatologie dépend essentiellement de la sévérité de la bradycardie résultante, de la perte de la synchronisation auriculo-ventriculaire et de la présence d’une cardiopathie sous-jacente.
Le bloc AV du premier degré est quasi systématiquement asymptomatique, bien qu’un PR extrêmement long puisse causer des symptômes d’insuffisance cardiaque diastolique.
Le bloc AV du second degré type Mobitz 1 est souvent asymptomatique ou se manifeste par une sensation de « ratés » cardiaques ou de palpitations irrégulières. Le type Mobitz 2 et les blocs de haut degré sont plus volontiers symptomatiques : asthénie marquée, intolérance à l’effort, dyspnée d’effort, vertiges, ou lipothymies.
Le bloc AV du troisième degré est une urgence médicale. Il entraîne une réduction marquée du débit cardiaque. Les symptômes incluent :
- Syncope à l’emporte-pièce (syndrome d’Adams-Stokes) : perte de connaissance brutale et brève, sans prodromes, due à une asystolie transitoire avant la reprise d’un rythme d’échappement.
- Insuffisance cardiaque congestive (dyspnée, orthopnée) aggravée par la bradycardie.
- Angor fonctionnel (par hypoperfusion coronaire diastolique et augmentation de la contrainte pariétale).
- Confusion cérébrale (hypoperfusion cérébrale), particulièrement chez le sujet âgé, pouvant mimer une démence ou un AVC.
Signes physiques à l’examen
L’auscultation cardiaque et l’examen clinique peuvent orienter le diagnostic avant même l’ECG :
- Bruit de canon (Ondes A canon) : Visibles au niveau du pouls jugulaire, elles correspondent à la contraction de l’oreillette contre une valve tricuspide fermée (dissociation AV).
- Bruit B1 à intensité variable : Caractéristique du BAV complet et de la dissociation, l’intensité du premier bruit du cœur change selon la position des valves auriculo-ventriculaires au moment de la systole ventriculaire.
- Bradycardie régulière qui ne s’accélère pas ou peu à l’effort.
Étiologies des blocs AV
L’enquête étiologique doit distinguer les causes réversibles (qui peuvent ne pas nécessiter de stimulateur cardiaque permanent) des causes irréversibles ou structurelles.
- Dégénérescence idiopathique (Maladie de Lenègre ou de Lev) : Cause la plus fréquente chez le sujet âgé. Il s’agit d’une fibrose progressive et sclérosante du système de conduction, sans autre cardiopathie évidente.
- Cardiopathie ischémique :
- Infarctus inférieur (coronaire droite) : Provoque souvent un bloc nodal (Mobitz 1 ou BAV complet) par ischémie du nœud AV et réflexe de Bezold-Jarisch (hypervagotonie). Le rythme d’échappement est généralement jonctionnel à QRS fins, et le bloc est souvent transitoire (récupération en quelques jours).
- Infarctus antérieur (IVA) : Provoque des blocs infranodaux (souvent précédés de blocs de branche droits ou gauches). Il témoigne d’une nécrose étendue du septum interventriculaire. Le risque d’asystolie est majeur et le bloc est souvent définitif, nécessitant un appareillage.
- Causes médicamenteuses (iatrogènes) : Très fréquentes. Bêta-bloquants, inhibiteurs calciques non-dihydropyridines (vérapamil, diltiazem), digoxine, amiodarone, autres antiarythmiques de classe I (flécaïnide) ou III (sotalol), clonidine. Ces causes sont potentiellement réversibles à l’arrêt du traitement ou après dialyse pour certaines toxines.
- Hypertonie vagale : Sportifs de haut niveau (souvent durant le sommeil, BAV 1 ou Mobitz 1 nocturne physiologique), syncopes vasovagales, hypersensibilité du sinus carotidien.
- Causes infectieuses et inflammatoires :
- Endocardite infectieuse (abcès septal comprimant les voies de conduction, surveiller l’allongement du PR).
- Myocardites (virale, grippale, COVID-19, maladie de Chagas, diphtérie).
- Borréliose de Lyme : À évoquer systématiquement devant un BAV de haut degré chez un patient jeune ou exposé (Cardite de Lyme), souvent résolutif sous antibiotiques.
- Sarcoïdose cardiaque (granulomes septaux), maladies de système (Lupus érythémateux disséminé, Polyarthrite rhumatoïde, Spondylarthrite ankylosante).
- Maladies infiltratives et génétiques :
- Amylose cardiaque (TTR ou AL).
- Laminopathies (mutation du gène LMNA), myopathies mitochondriales (syndrome de Kearns-Sayre), dystrophie myotonique de Steinert.
- Causes métaboliques : Hyperkaliémie sévère (élargissement des QRS et troubles conductifs), hypercalcémie, hypothermie.
- Post-chirurgical : Après chirurgie valvulaire (aortique, mitrale ou tricuspide), remplacement valvulaire aortique percutané (TAVI), cure de CIA ou ablation par cathéter proche du nœud AV.
- Congénital : Bloc AV congénital (isolé ou associé au lupus néonatal par passage d’anticorps anti-Ro/SSA maternels).
Localisation du niveau du bloc et approche diagnostique
La localisation du niveau du bloc (nodal vs infranodal) est le déterminant principal du pronostic. Un bloc nodal est généralement bénin avec un échappement stable, tandis qu’un bloc infranodal (Hisien ou infra-Hisien) comporte un risque élevé d’asystolie et de mort subite.
Critères ECG et manœuvres dynamiques
La largeur du QRS est un indice fondamental mais pas absolu :
- QRS fin (< 0,12 s) : Le bloc est le plus souvent situé dans le nœud AV ou le faisceau de His proximal. Le rythme d’échappement est jonctionnel (40-60 bpm), fiable.
- QRS large (> 0,12 s) : Suggère un bloc infranodal (branches du faisceau) avec un échappement ventriculaire lent (< 35 bpm) et instable. Attention, un bloc nodal peut coexister avec un bloc de branche préexistant, donnant des QRS larges (piège diagnostique).
Manœuvres pharmacologiques et vagales :
- Atropine (test pharmacologique) : L’atropine lève le tonus vagal. Elle améliore la conduction nodale (réduit le bloc si nodal : augmentation de la fréquence ventriculaire). À l’inverse, en cas de bloc infranodal, l’atropine augmente la fréquence sinusale mais le bloc persiste ou s’aggrave (aggravation du ratio de blocage) car on « fatigue » davantage le système His-Purkinje malade.
- Massage sinocarotidien : Ralentit la conduction nodale (aggrave un bloc nodal) mais peut paradoxalement améliorer un bloc infranodal de haut degré en ralentissant la fréquence auriculaire (permettant aux tissus de sortir de leur période réfractaire).
Bilan paraclinique et évaluation
Devant la découverte d’un bloc AV, le bilan doit être adapté à la stabilité clinique et à l’âge du patient :
- ECG 12 dérivations : Indispensable pour classifier le bloc et rechercher des signes d’ischémie (onde Q, sus-décalage ST).
- Biologie : Ionogramme (Kaliémie +++), Troponine (SCA ?), fonction rénale, TSH, bilan inflammatoire (CRP). Sérologie de Lyme selon contexte. Digoxinémie si traitement en cours. Bilan génétique dans les formes familiales.
- Holter ECG ou Télémétrie : Pour les blocs paroxystiques, pour quantifier la charge en bradycardie et pour corréler les symptômes aux anomalies de conduction (recherche de pauses diurnes/nocturnes).
- Échocardiographie : Recherche de cardiopathie structurelle, dysfonction VG, calcifications valvulaires mitro-aortiques, troubles de la cinétique segmentaire, hypertrophie ou aspect granité (amylose).
- Imagerie en coupe (IRM Cardiaque / TEP) : Indiquée chez le sujet jeune (< 60 ans) présentant un BAV inexpliqué, pour rechercher une sarcoïdose cardiaque, une myocardite ou une fibrose spécifique.
- Exploration Électrophysiologique endocavitaire (EEP) : Examen invasif, rarement nécessaire de nos jours. Indiquée en cas de BAV 2:1 à QRS fins sans cause évidente, pour mesurer l’intervalle H-V (His-Ventricule). Un H-V > 70 ms (ou > 100 ms sous épreuve) signe une atteinte infranodale grave nécessitant un pacemaker.
Stratégies de prise en charge thérapeutique
Prise en charge aiguë
En présence d’un BAV symptomatique (syncope, insuffisance cardiaque) ou hémodynamiquement instable :
- Atropine : 0,5 à 1 mg IV (Bolus), répété si besoin (max 3 mg). Efficace surtout sur les blocs nodaux. À utiliser avec prudence dans les blocs infranodaux larges (risque d’aggravation paradoxale).
- Isoprénaline (Isuprel) : En perfusion continue à la seringue électrique si l’atropine est inefficace. C’est le traitement pharmacologique de choix pour augmenter la fréquence de l’échappement ventriculaire en attendant la stimulation.
- Stimulation cardiaque temporaire :
- Transcutanée (externe) : via les patchs du défibrillateur. Mesure d’urgence immédiate mais douloureuse (nécessite une sédation/analgésie) et instable (problèmes de capture chez les patients obèses ou emphysémateux).
- Transveineuse (sonde d’entraînement électrosystolique – SEES) : voie fémorale ou jugulaire, montée dans le ventricule droit. Permet une stabilisation fiable avant implantation définitive ou si la cause est réversible (ex: surdosage médicamenteux).
Stimulation cardiaque définitive (Pacemaker)
L’implantation d’un stimulateur cardiaque (PM) est régie par les recommandations internationales (ESC/AHA/ACC). En résumé, le PM est indiqué pour :
- Tout BAV du 3ème degré (complet) symptomatique ou asymptomatique (sauf cause transitoire et réversible avérée), surtout si QRS larges ou pauses > 3 secondes.
- BAV du 2ème degré type Mobitz 2, quel que soit les symptômes, en raison du risque d’évolution imprévisible vers le BAV complet.
- BAV du 2ème degré type Mobitz 1, seulement s’il est symptomatique ou si la localisation infranodale est prouvée à l’EEP.
- BAV alternant (bloc de branche bascule).
Choix du mode de stimulation : Le stimulateur double chambre (DDD) est privilégié pour maintenir le synchronisme auriculo-ventriculaire, essentiel à la fonction cardiaque physiologique. Chez les patients en fibrillation atriale permanente, un mode ventriculaire seul (VVI) est suffisant. De plus en plus, la stimulation des voies de conduction physiologiques (stimulation du faisceau de His ou de la branche gauche) est privilégiée par rapport à la stimulation apicale droite classique, afin d’éviter la dyssynchronie ventriculaire induite par le pacing.
