Approche des patients souffrant de douleurs thoraciques : diagnostics différentiels, prise en charge et ECG
Approche des patients souffrant de douleurs thoraciques : diagnostics différentiels, évaluation et prise en charge
La douleur thoracique est l’un des symptômes les plus fréquents dans les services d’urgence (représentant environ 5 à 20 % des admissions), ainsi que dans les services de soins de santé primaires. La cause (étiologie) de la douleur thoracique varie considérablement en fonction de la population étudiée, de l’âge, du sexe, des facteurs de risque cardiovasculaire et du profil symptomatique. La douleur thoracique est l’un des symptômes les plus nuancés de la pratique clinique ; il est fondamental de pouvoir différencier avec certitude les étiologies bénignes (musculo-squelettiques, psychogènes) des étiologies graves nécessitant une intervention immédiate. Par conséquent, lorsqu’un patient présente une douleur thoracique, la première tâche, avant même de chercher un diagnostic précis, consiste à exclure ou à vérifier les causes pouvant mettre en jeu le pronostic vital immédiat (les « Big Five » ou « Killer Six ») :
- Cardiopathie ischémique (Syndromes Coronariens Aigus – SCA) : cela englobe l’angine de poitrine instable et l’infarctus aigu du myocarde (IAM), qu’il soit avec ou sans élévation du segment ST. L’angine stable, bien que pathologique, ne met pas en jeu le pronostic vital immédiat de la même manière. Il convient également de considérer l’infarctus de type 2 (déséquilibre offre/demande sans rupture de plaque) et le MINOCA (infarctus sans obstruction coronaire significative).
- Dissection aortique aiguë : une urgence chirurgicale (Type A de Stanford) ou médicale (Type B) absolue nécessitant un diagnostic rapide pour éviter la rupture ou la tamponnade.
- Pneumothorax sous tension : pouvant entraîner un collapsus cardiovasculaire obstructif par compression des cavités cardiaques et déviation médiastinale.
- Embolie pulmonaire (EP) : en particulier les formes à haut risque avec instabilité hémodynamique ou dysfonction ventriculaire droite aiguë.
- Rupture de l’œsophage (Syndrome de Boerhaave) et Médiastinite : affections rares mais grevées d’une mortalité très élevée, survenant classiquement après des efforts de vomissement violents.
- Tamponnade cardiaque : souvent secondaire à une péricardite maligne, une dissection aortique rétrograde ou un traumatisme, entraînant une adiastolie.
Outre ces pathologies critiques, il existe de nombreuses autres causes de douleurs thoraciques, souvent subaiguës ou chroniques (reflux gastro-œsophagien, douleurs pariétales, zona, etc.). L’anamnèse doit être systématique et précise, car elle suffit souvent à orienter le diagnostic vers une probabilité clinique élevée (« pre-test probability »). Une évaluation structurée permet d’éviter l’errance diagnostique et la prescription d’examens inutiles. Le tableau ci-dessous présente une anamnèse systématique chez les patients présentant une douleur thoracique. Il est important que l’anamnèse et l’examen physique soient effectués systématiquement et soigneusement, sans retarder les mesures de réanimation si le patient est instable.
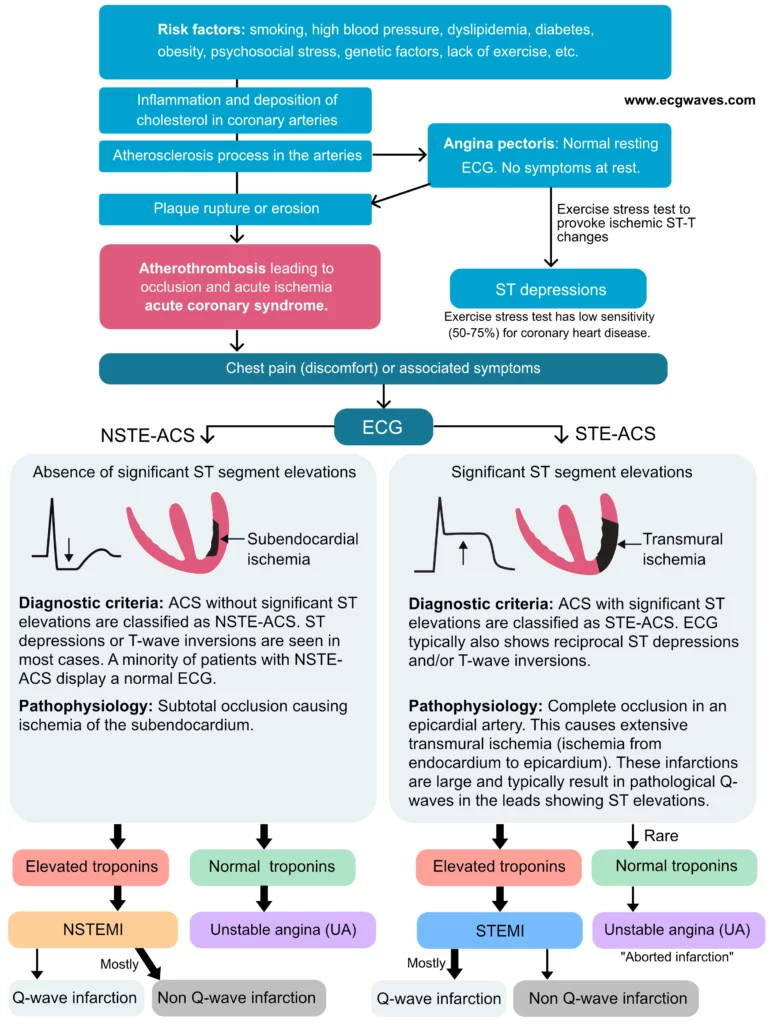
L’anamnèse, l’examen physique, l’ECG et les tests de laboratoire (biomarqueurs) constituent les piliers de la stratification du risque. Un ECG à 12 dérivations doit être enregistré et interprété impérativement dans les 10 minutes suivant le premier contact médical. L’ECG est l’outil pivot permettant de différencier les syndromes coronariens aigus avec sus-décalage du segment ST (STE-ACS), nécessitant une reperfusion immédiate, des syndromes coronariens aigus sans sus-décalage du segment ST (NSTE-ACS). La distinction entre STE-ACS et NSTE-ACS dicte la stratégie thérapeutique immédiate (fibrinolyse ou angioplastie primaire vs stratégie invasive précoce). En outre, la corrélation entre la douleur et les modifications électriques est cruciale : un ECG enregistré pendant l’épisode douloureux qui ne montre aucune modification du segment ST ou de l’onde T rend l’ischémie myocardique sévère moins probable, bien qu’elle ne l’exclue pas totalement (ex: occlusion de la circonflexe donnant une zone silencieuse à l’ECG standard). Pour plus de détails physiopathologiques, reportez-vous à la section La cascade ischémique.
Anamnèse chez les patients souffrant de douleurs thoraciques (gêne thoracique)
L’interrogatoire doit rechercher les caractéristiques sémiologiques de la douleur (PQRST : Provocation, Qualité, Région/Irradiation, Sévérité, Temps) ainsi que le terrain du patient. Il est crucial de noter que le terme « douleur » peut être trompeur; de nombreux patients ischémiques décrivent plutôt une « gêne », un « inconfort » ou une « oppression ».
| PARAMÈTRES DE L’ANAMNÈSE | QUESTIONS | COMMENTAIRES CLINIQUES |
|---|---|---|
| Facteurs de risque cardiovasculaire (FRCV) | Antécédents familiaux (hérédité coronarienne précoce : <55 ans chez l’homme, <65 ans chez la femme, dissection aortique, maladie thromboembolique). Hypertension artérielle. Tabagisme (actif ou sevré). Dyslipidémie. Obésité et/ou diabète de type 1 ou 2. Stress psychosocial. Insuffisance rénale chronique. Maladie vasculaire athérosclérotique établie (AVC, AOMI). Maladies inflammatoires chroniques (ex: polyarthrite rhumatoïde, lupus). |
La présence de multiples FRCV augmente la probabilité pré-test d’une coronaropathie (CAD). Cependant, l’absence de facteurs de risque n’exclut pas un SCA, en particulier chez les sujets jeunes (penser à la cocaïne, amphétamines, thrombophilie). La dissection aortique est fortement associée à l’HTA non contrôlée et aux maladies du tissu conjonctif (Marfan, Ehlers-Danlos, Loeys-Dietz). L’embolie pulmonaire doit être évoquée en cas d’antécédents de TVP/EP, de cancer actif, d’immobilisation ou de chirurgie récente. |
| Facteurs déclenchants et de soulagement | Symptômes déclenchés par l’exercice ou l’effort (seuil ischémique) ? Symptômes au repos ? Symptômes post-prandiaux (vol gastrique) ? Stress émotionnel ? Influence de la position ou de la respiration ? |
L’angor typique est déclenché par l’effort et cède au repos en < 10 min. Une douleur pleurétique (aggravée par l’inspiration/toux) évoque une pathologie pulmonaire (EP, pneumothorax, pneumonie) ou péricardique. Une douleur positionnelle (soulagée en antéflexion) est typique de la péricardite. Une douleur reproductible à la palpation oriente vers une cause pariétale (mais n’exclut pas formellement un SCA : sensibilité de 15% pour l’ischémie). |
| Début et évolution temporelle | Début brutal (« coup de tonnerre ») ou progressif ? Durée de l’épisode ? Caractère intermittent ou continu ? |
Un début brutal, maximal d’emblée, doit faire suspecter une dissection aortique, une EP ou un pneumothorax. La douleur ischémique s’installe généralement progressivement sur quelques minutes (crescendo). Une douleur très brève (< quelques secondes) ou très prolongée (plusieurs jours) sans fluctuation est rarement d’origine ischémique instable. |
| Localisation et Irradiation | Où se situe l’épicentre ? Irradiations (bras, mâchoire, dos) ? Localisation rétrosternale ou latérale ? |
La douleur coronarienne est typiquement rétrosternale, diffuse, irradiant vers les épaules, les bras (surtout gauche, face ulnaire, mais l’irradiation bilatérale ou droite est très spécifique), la mâchoire ou le cou. Une irradiation dorsale interscapulaire doit faire évoquer une dissection aortique. L’épigastralgie peut être le seul signe d’un infarctus inférieur (attention aux diagnostics erronés de gastrite). |
| Qualité de la douleur | Sensation de poids, étau, brûlure, déchirement, coup de poignard ? | SCA : Constriction (« étau »), pression, lourdeur, oppression. Dissection : Déchirement, sensation de mort imminente, douleur migratoire. Péricardite/Pleurésie : Brûlure, coup de poignard, sensation de « respiration coupée ». RGO : Brûlure ascendante (pyrosis). |
| Symptômes associés | Signes neurovégétatifs ? Dyspnée ? Syncope ? Palpitations ? Hémoptysie ? |
SCA : Diaphorèse (sueurs profuses), nausées, vomissements sont fréquents (surtout dans l’infarctus inférieur par réflexe vagal). Dyspnée aiguë : Équivalent angineux fréquent (surtout chez le diabétique/âgé) ou signe d’insuffisance cardiaque gauche aiguë. Syncope : Signe de gravité (trouble du rythme ventriculaire, EP massive, dissection, sténose aortique serrée). Hémoptysie : Évocateur d’EP ou de sténose mitrale. |
| Réponse à la Nitroglycérine | Soulagement rapide (< 5 min) ? | Si la douleur cède rapidement sous trinitrine, l’origine ischémique est probable mais non pathognomonique (le spasme œsophagien répond aussi aux dérivés nitrés). L’absence de réponse n’exclut pas l’infarctus (surtout en phase constituée). L’effet placebo est également possible. |
Pour standardiser l’évaluation fonctionnelle des patients souffrant d’angine de poitrine stable, on utilise la classification de la Société canadienne de cardiologie (SCC), analogue à la classification NYHA pour l’insuffisance cardiaque. Cette classification permet de suivre l’évolution des symptômes et l’efficacité des traitements anti-angineux :
| Grade I | L’activité physique ordinaire ne provoque pas d’angine (marche, montée d’escaliers). Angine uniquement lors d’un effort intense, rapide ou prolongé. |
| Grade II | Légère limitation de l’activité ordinaire. Angine à la marche rapide, en côte, après les repas, au froid, ou sous stress émotionnel. Capacité de marcher plus de deux pâtés de maisons sur le plat ou de monter plus d’un étage. |
| Grade III | Limitation marquée de l’activité physique ordinaire. Angine en marchant un ou deux pâtés de maisons sur le plat ou en montant un étage à pas normal. |
| Grade IV | Incapacité d’exercer une activité physique sans gêne ; le syndrome angineux peut être présent au repos. |
Caractéristiques cliniques des différentes étiologies
Douleur thoracique ischémique : angine de poitrine et syndromes coronariens aigus
La douleur thoracique ischémique est viscérale, souvent décrite comme une gêne diffuse, profonde, difficile à localiser avec un seul doigt (signe de Levine : le patient place son poing ou sa main ouverte sur le thorax). Elle est ressentie comme une constriction, une pression ou un écrasement. Les irradiations classiques incluent le bras gauche (bord ulnaire), les deux bras, le cou, la mâchoire, ou l’épigastre. Il est important de noter que l’irradiation vers le bras droit ou les deux bras a une spécificité élevée pour l’infarctus du myocarde.
Présentations atypiques : Les femmes, les patients âgés (> 75 ans), les diabétiques et les insuffisants rénaux présentent fréquemment des symptômes atypiques, parfois qualifiés d’ »équivalents angineux ». Le symptôme dominant peut être une dyspnée isolée, une fatigue extrême inexpliquée, des lipothymies, une anxiété inexpliquée ou des troubles digestifs. Chez la personne âgée, la confusion mentale ou une chute inexpliquée peuvent être les seuls signes d’un infarctus.
La distinction entre les formes stables et instables est physiopathologique et clinique :
- Angine de poitrine stable : Due à une sténose coronarienne fixe limitant le flux sanguin à l’effort (déséquilibre apport/demande). La douleur est prévisible, reproductible pour un même niveau d’effort, dure moins de 5 à 10 minutes et cède au repos ou à la prise de trinitrine.
- Syndromes Coronariens Aigus (SCA) : Ils résultent généralement de la rupture ou de l’érosion d’une plaque d’athérosclérose (Type 1 MI) entraînant une thrombose coronarienne aiguë. On distingue :
- Angine de poitrine instable : Douleur survenant au repos (> 20 min), de novo (récente et sévère d’emblée) ou crescendo (aggravation d’un angor stable préalable). Contrairement à l’infarctus, il n’y a pas de libération significative de biomarqueurs de nécrose (troponines négatives).
- Infarctus aigu du myocarde (NSTEMI et STEMI) : Présence de nécrose myocytaire confirmée par l’élévation des troponines. La douleur est souvent plus intense, dure plus longtemps (> 20-30 min) et s’accompagne de signes neurovégétatifs. Le STEMI (occlusion totale) nécessite une reperfusion immédiate, tandis que le NSTEMI (occlusion partielle ou intermittente) nécessite une stratification du risque pour décider du délai de la coronarographie.
- MINOCA (Myocardial Infarction with Non-Obstructive Coronary Arteries) : Environ 5 à 10 % des patients présentant des critères d’infarctus n’ont pas de sténose coronarienne significative à l’angiographie. Les causes incluent le vasospasme, la micro-embolie, ou la dissection spontanée des coronaires (SCAD), cette dernière étant plus fréquente chez la femme jeune.
Péricardite et périmyocardite
- La péricardite aiguë provoque une douleur thoracique rétrosternale ou latérosternale gauche. Elle survient souvent après un épisode viral (syndrome grippal).
- Caractère pleurétique et positionnel : La douleur est classiquement augmentée par l’inspiration profonde (mimant une pleurésie) et par le décubitus dorsal. Elle est soulagée par la position assise penchée en avant (position de prière mahométane).
- À l’auscultation, un frottement péricardique (bruit superficiel, rapeux, systolo-diastolique comparable au crépitement du cuir neuf) est pathognomonique mais inconstant et fugace.
- L’ECG peut montrer un sus-décalage diffus du segment ST (concave vers le haut) et un sous-décalage du segment PR.
- Le diagnostic requiert cliniquement la présence d’au moins 2 des 4 critères : douleur thoracique typique, frottement péricardique, modifications ECG suggestives, et épanchement péricardique (nouveau ou aggravé) à l’échocardiographie.
Douleur thoracique d’origine vasculaire (dissection aortique)
La dissection aortique est un diagnostic redoutable qui peut mimer un infarctus (et parfois s’y associer si la dissection atteint les ostia coronaires, souvent l’artère coronaire droite entraînant un sus-décalage ST en inférieur). La douleur est :
- Brutale et maximale d’emblée : Contrairement à la douleur crescendo de l’angor. C’est l’un des discriminants les plus puissants.
- Type : Décrite comme une déchirure, un coup de poignard ou une sensation de cisaillement intéro-postérieur.
- Migration : La douleur peut migrer le long du trajet aortique (du thorax vers le dos, les lombes, puis les jambes).
- Signes associés : Déficit neurologique focal (AVC ischémique), syncope, douleur abdominale (ischémie mésentérique), ou ischémie aiguë de membre.
Douleur thoracique gastro-intestinale
- Le reflux gastro-œsophagien (RGO) et les spasmes œsophagiens sont les diagnostics différentiels les plus fréquents des douleurs thoraciques non cardiaques.
- Les spasmes œsophagiens diffus peuvent provoquer une douleur constrictive rétrosternale soulagée par les dérivés nitrés (relâchement du muscle lisse) et inhibiteurs calciques, ce qui entraîne souvent une confusion diagnostique avec l’angor.
- L’anamnèse recherche un lien avec les repas, une position couchée post-prandiale, ou des symptômes de dyspepsie.
- Rupture de l’œsophage (Syndrome de Boerhaave) : À évoquer devant une douleur thoracique atroce survenant après des vomissements violents, accompagnée d’emphysème sous-cutané (crépitations cervicales). C’est une urgence vitale.
Douleur thoracique pulmonaire
- Embolie Pulmonaire (EP) : La douleur est typiquement latéro-thoracique, basi-thoracique, brutale et pleurétique (point de côté). Elle s’accompagne souvent d’une dyspnée inexpliquée, d’une tachypnée et d’une tachycardie. La présence de facteurs de risque thromboemboliques (évalués par le Score de Wells ou le Score de Genève) est un élément clé pour déterminer la nécessité d’imagerie.
- Pneumothorax : Douleur brutale avec dyspnée, tympanisme à la percussion et abolition du murmure vésiculaire du côté atteint. Il survient souvent chez le sujet jeune, longiligne et fumeur (pneumothorax spontané).
- Pneumonie : Douleur pleurale associée à un syndrome infectieux (fièvre, toux, expectorations).
Douleur thoracique musculo-squelettique
C’est une cause fréquente aux urgences, mais un diagnostic d’exclusion.
- La douleur est reproductible à la palpation précise d’une zone ou à la mobilisation du thorax/bras.
- Syndrome de Tietze : Tuméfaction douloureuse (inflammation) des cartilages costosternaux (souvent 2e ou 3e côte). À distinguer de la costochondrite simple qui ne présente pas de tuméfaction.
- Causes vertébrales : Une hernie discale dorsale ou une arthrose peut projeter une douleur en ceinture (radiculalgie).
Origine psychogène (Trouble panique / Anxiété)
L’anxiété et les attaques de panique sont des diagnostics d’exclusion. La douleur est souvent précordiale gauche, punctiforme (désignée du doigt), ou inframammaire, sans lien avec l’effort. Elle s’accompagne d’hyperventilation, de paresthésies des extrémités et péribuccales (alcalose respiratoire), et de palpitations. Il est crucial de ne pas étiqueter hâtivement un patient comme « anxieux » avant d’avoir exclu les causes organiques, car l’embolie pulmonaire ou l’hypoxie peuvent elles-mêmes induire une anxiété majeure (sensation de « soif d’air »).
Examen physique
L’examen clinique doit être orienté vers la recherche de signes de gravité hémodynamique et d’indices étiologiques spécifiques :
- Signes vitaux (ABCDE) : Pression artérielle, fréquence cardiaque, fréquence respiratoire, saturation en O2, température. Une hypotension ou une tachycardie signent une instabilité potentielle.
- Cardiovasculaire :
- Asymétrie tensionnelle : Mesurer la PA aux deux bras. Une différence systolique > 15-20 mmHg suggère une dissection aortique ou une sténose sous-clavière.
- Auscultation : Rechercher un souffle d’insuffisance aortique (dissection rétrograde), un souffle systolique nouveau (sténose aortique, cardiomyopathie hypertrophique, ou complication mécanique de l’infarctus comme l’insuffisance mitrale par rupture de pilier ou communication interventriculaire), un frottement péricardique, ou un bruit de galop (S3/S4) témoignant d’une dysfonction ventriculaire ou d’une ischémie.
- Insuffisance cardiaque : Turgescence jugulaire (signe de défaillance droite), reflux hépato-jugulaire, œdèmes des membres inférieurs.
- Pulmonaire : Auscultation asymétrique (pneumothorax, épanchement), crépitants (OAP, pneumonie, fibrose), sibilants.
- Paroi thoracique : La reproduction exacte de la douleur à la palpation est un argument fort pour une origine pariétale, mais une douleur pariétale peut coexister avec un SCA (ne pas exclure l’ischémie sur ce seul critère chez un patient à risque).
- Vasculaire périphérique : Palpation des pouls (déficit de pouls dans la dissection ou l’AOMI). Recherche de signes de phlébite (TVP) en faveur d’une EP. La palpation abdominale doit systématiquement rechercher une masse pulsatile (anévrisme de l’aorte abdominale).
Stratégie diagnostique et examens complémentaires
L’évaluation repose sur l’estimation de la probabilité clinique pré-test et l’utilisation de scores de stratification (Score HEART, GRACE, ou Marburg en soins primaires) pour guider l’hospitalisation ou la sortie.
L’Électrocardiogramme (ECG)
L’ECG 12 dérivations est l’examen central. Il doit être répété (ECG sériés) toutes les 15-30 minutes si le premier est non diagnostique mais que la suspicion clinique persiste, ou en cas de récidive douloureuse. La comparaison avec un tracé antérieur, s’il est disponible, est précieuse pour identifier des modifications nouvelles.
ECG en cas d’ischémie myocardique : modifications ischémiques du segment ST et de l’onde T
Dépression du segment ST dans l’ischémie myocardique et diagnostics différentiels
Élévation du segment ST dans l’ischémie myocardique aiguë et diagnostics différentiels
Pièges ECG : Environ 30 à 50 % des SCA se présentent initialement avec un ECG normal ou non spécifique. Il faut rechercher des signes subtils d’occlusion coronaire aiguë comme :
- Signe de de Winter : Sous-décalage ascendant du segment ST au point J associé à des ondes T géantes symétriques en précordiales (équivalent STEMI antérieur par occlusion de l’IVA).
- Syndrome de Wellens : Ondes T biphasiques ou profondément inversées en V2-V3 (sténose critique de l’IVA proximale, risque imminent d’infarctus antérieur massif).
- Infarctus postérieur : Sous-décalage ST horizontal en V1-V3 avec grandes ondes R et ondes T positives (image en miroir). Nécessite d’enregistrer les dérivations postérieures (V7, V8, V9) pour confirmer le sus-décalage.
- Bloc de branche : Un bloc de branche gauche (BBG) nouveau ou présumé nouveau, ou un bloc de branche droit avec anomalies de repolarisation concordantes, doit faire suspecter une ischémie.
Pour plus de détails techniques sur ces anomalies : Ondes T en cas d’ischémie : hyperaiguë, inversée (négative), signe de Wellens et signe de Winter.
Examens de laboratoire : Les Troponines Haute Sensibilité
Le dosage de la Troponine haute sensibilité (hs-cTn T ou I) est le standard actuel pour diagnostiquer la lésion myocardique. Contrairement aux anciennes troponines qui nécessitaient d’attendre 6 à 12 heures, les troponines hs permettent une détection beaucoup plus précoce.
- Définition universelle de l’infarctus : Elle requiert la détection d’une hausse et/ou d’une baisse de la troponine cardiaque avec au moins une valeur > 99e percentile, associée à des preuves d’ischémie (symptômes, ECG, imagerie).
- Algorithmes 0h/1h ou 0h/2h (ESC Guidelines) : Il est recommandé de prélever un échantillon à l’admission (0h) et un second 1 heure ou 2 heures plus tard. Cela permet de trier rapidement les patients (« Rule-out » / « Rule-in »).
- Lésion myocardique aiguë vs chronique : Le diagnostic de SCA repose sur l’élévation au-dessus du 99e percentile (URL) ET une variation significative (delta) entre les deux prélèvements (cinétique). Une troponine stablement élevée évoque une lésion myocardique chronique (insuffisance cardiaque structurelle, insuffisance rénale chronique) plutôt qu’un infarctus aigu.
- Causes non ischémiques d’élévation : Une troponine élevée n’est pas synonyme d’infarctus. D’autres causes incluent : Embolie pulmonaire, myocardite, sepsis, urgence hypertensive, tachyarythmies, et cardiomyopathie de Takotsubo.
- D-dimères : Uniquement si la probabilité clinique d’EP ou de dissection est faible ou intermédiaire. S’ils sont négatifs, ils excluent l’EP (haute valeur prédictive négative). Si la probabilité est forte, il faut passer directement à l’imagerie.
- BNP / NT-proBNP : Utile en cas de dyspnée pour différencier une cause cardiaque d’une cause pulmonaire et pour le pronostic.
Examens radiologiques et Imagerie
La stratégie d’imagerie dépend de la stabilité du patient et de la suspicion clinique :
- Radiographie thoracique : Examen de débrouillage (élargissement du médiastin, pneumothorax, pneumonie, OAP), mais peu sensible pour les SCA ou l’EP.
- Échocardiographie au lit du patient (POCUS) : Indispensable en cas de choc ou de suspicion de tamponnade/dissection. Elle recherche des troubles de la cinétique segmentaire (SCA), une dilatation du VD (EP), un épanchement péricardique ou une valvulopathie sévère.
- Angioscanner thoracique (CTPA) : L’examen de choix (« Gold Standard ») pour exclure l’embolie pulmonaire et la dissection aortique (protocole « Triple Rule-Out » possible visualisant aorte, artères pulmonaires et coronaires).
- Coroscanner (CT coronaire) : De plus en plus utilisé et recommandé (Recommandation Classe I) chez les patients à risque faible ou intermédiaire avec ECG et troponines non concluants, pour exclure formellement une sténose coronaire (haute valeur prédictive négative) et permettre une sortie rapide.
- Tests fonctionnels non invasifs : L’échocardiographie de stress, l’IRM de stress ou la scintigraphie myocardique sont indiquées chez les patients stables après exclusion d’un SCA, pour rechercher une ischémie inductible.
Approche thérapeutique initiale immédiate
En attendant la confirmation diagnostique, une prise en charge symptomatique et préventive doit être initiée, en suivant le principe de prudence :
- Mise en condition : Voie veineuse périphérique, monitorage ECG continu, saturation O2. L’oxygénothérapie systématique n’est plus recommandée et doit être réservée aux patients hypoxémiques (SatO2 < 90% ou PaO2 < 60 mmHg) pour éviter la vasoconstriction hyperoxique.
- Soulagement de la douleur : La gestion de la douleur est primordiale pour réduire la stimulation sympathique. Les dérivés nitrés sublinguaux sont indiqués en cas de douleur ischémique probable (contre-indication si prise récente d’inhibiteurs de la phosphodiestérase-5 ou suspicion d’infarctus du VD). Les opiacés (morphine) doivent être utilisés avec prudence et uniquement pour les douleurs réfractaires, car ils peuvent ralentir l’absorption des antiplaquettaires oraux.
- Traitement antithrombotique (si suspicion de SCA) : Aspirine (dose de charge 160-325 mg à croquer, non enrobée) dès que le diagnostic de dissection aortique est jugé peu probable. L’ajout d’un deuxième antiagrégant (P2Y12 inhibiteur : ticagrelor, prasugrel ou clopidogrel) et d’anticoagulants (héparine non fractionnée ou énoxaparine) se fait généralement après confirmation diagnostique ou selon les protocoles locaux, en fonction du risque hémorragique.