«
Dysfonctionnement du stimulateur cardiaque, dépannage et ECG
L’ECG conventionnel de surface est un outil fondamental pour le diagnostic des dysfonctionnements de stimulation. Il peut révéler les anomalies suivantes :
- Défaut de capture (Failure to Capture – FTC) : le stimulateur délivre une impulsion électrique (visible sous forme de spike), mais celle-ci n’entraîne pas de dépolarisation (activation) du myocarde.
- Défaut de stimulation (Failure to Output / Failure to Pace) : le stimulateur cardiaque ne délivre pas d’impulsion électrique alors qu’il devrait le faire (absence de spike).
- Surdétection (Oversensing) : le stimulateur détecte des signaux électriques inappropriés (ondes T, myopotentiels, interférences électromagnétiques) qu’il interprète à tort comme des événements cardiaques intrinsèques. Cela conduit généralement à une inhibition injustifiée de la stimulation (pauses).
- Défaut de détection ou Sous-détection (Undersensing) : le dispositif ne détecte pas les véritables ondes P ou R intrinsèques. Cela entraîne une stimulation asynchrone, avec un risque de compétition entre le rythme intrinsèque et le rythme stimulé (risque de phénomène R-sur-T).
- Défaut d’ajustement de la fréquence (Rate modulation failure) : le capteur d’asservissement n’adapte pas correctement la fréquence de stimulation aux besoins métaboliques du patient (incompétence chronotrope ou accélération inappropriée).
Ces défaillances se traduisent généralement sur l’ECG par des artefacts de stimulation manquants, des spikes inefficaces, une stimulation irrégulière ou des pauses. L’étiologie des dysfonctionnements peut être liée au matériel (générateur d’impulsions, batterie épuisée, impédance anormale, rupture ou déplacement de sonde) ou à l’interface tissu-électrode (fibrose). Les causes systémiques comprennent les troubles électrolytiques (hyperkaliémie), les troubles métaboliques, l’hypoxémie sévère, et l’usage de médicaments antiarythmiques (notamment de classe Ic) qui élèvent les seuils de stimulation.
Vous trouverez ci-dessous des tracés ECG illustrant chaque type de défaillance, suivis d’une analyse détaillée des mécanismes et de la conduite à tenir.
Défaut de stimulation (Absence de spike)
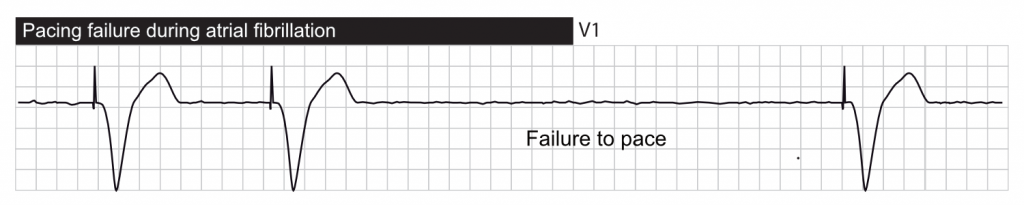
On parle de défaut de stimulation (failure to output) lorsque l’artefact de stimulation est absent sur l’ECG alors que la fréquence cardiaque est inférieure à la fréquence minimale programmée. Ce problème est potentiellement létal chez les patients stimulodépendants.
Les causes principales incluent :
- Épuisement de la batterie : En fin de vie (EOL – End of Life), le stimulateur cesse de fonctionner. Avant cela, en phase de remplacement électif (ERI), le mode de stimulation change souvent (passage en VVI ou modification de la fréquence magnétique).
- Rupture de sonde ou problème de connexion : Une fracture complète du conducteur (« open circuit ») empêche la délivrance du courant.
- Surdétection (Oversensing) : C’est la cause la plus fréquente de « faux » défaut de stimulation. Le stimulateur est inhibé par des bruits parasites qu’il interprète comme des battements cardiaques.
- Interférence (Cross-talk) : Une impulsion auriculaire détectée sur le canal ventriculaire peut inhiber la sortie ventriculaire (inhibition croisée).
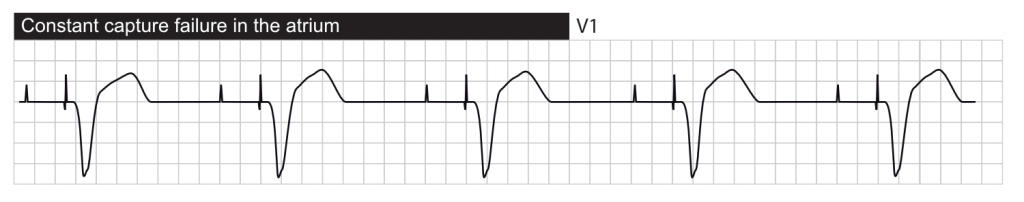
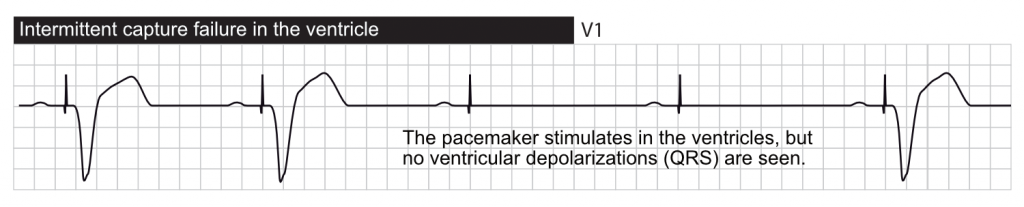
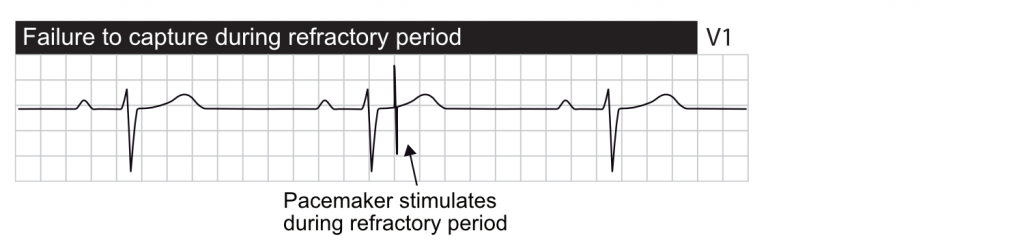
Absence de capture (Failure to Capture)
Définition : la stimulation est délivrée (spike visible) mais n’entraîne pas de dépolarisation du myocarde (pas de P ou de QRS consécutif).
Il convient de distinguer deux types d’échec de capture :
- L’échec authentique de la capture se produit lorsqu’un stimulus censé entraîner une activation ne le fait pas. Cela traduit une inadéquation entre l’énergie délivrée et le seuil de stimulation du patient. Les causes incluent :
- Déplacement de sonde (micro-dislocation) ou perforation myocardique.
- Augmentation des seuils : Infarctus au niveau de l’interface sonde-tissu, hyperkaliémie sévère, acidose, ou médicaments stabilisants de membrane (Flecainide, Sotalol).
- Problèmes matériels : Rupture d’isolant (fuite de courant) ou fracture de sonde.
- L’échec fonctionnel de la capture se produit lorsqu’un stimulus est délivré pendant la période réfractaire absolue physiologique du myocarde. Un stimulus délivré pendant cette période ne peut pas entraîner d’activation car les cellules sont inexcitables. C’est un comportement normal, souvent vu lors d’extrasystoles non détectées.
La gestion clinique implique souvent l’augmentation temporaire de l’amplitude (voltage) ou de la durée d’impulsion via le programmateur. Les stimulateurs cardiaques modernes possèdent des algorithmes de Capture Management (Auto-Capture) qui vérifient cycle à cycle l’efficacité de la stimulation. Si une perte de capture est détectée, le dispositif délivre une impulsion de secours à haute énergie (souvent 4.5 V ou 5 V) et ajuste automatiquement les seuils.
Surdétection (Oversensing)
Il y a surdétection lorsque le stimulateur cardiaque détecte une activité électrique qu’il interprète à tort comme une activité auriculaire (onde P) ou ventriculaire (onde R) intrinsèque. Selon le mode programmé, cette détection entraîne généralement une inhibition de la stimulation (remise à zéro des compteurs), provoquant des pauses ventriculaires ou auriculaires.
«
Les sources de surdétection peuvent être physiologiques ou externes :
- Myopotentiels : L’activité des muscles pectoraux peut être détectée, particulièrement avec les stimulateurs unipolaires. Des manœuvres isométriques du bras peuvent reproduire le défaut lors du diagnostic.
- Onde T : Si l’onde T est ample ou si la sensibilité ventriculaire est trop élevée, le stimulateur peut compter l’onde T comme une nouvelle onde R (double comptage).
- Diaphonie (Crosstalk) : Le stimulus d’une chambre (souvent l’oreillette) est détecté par la sonde de l’autre chambre (le ventricule), entraînant une inhibition ventriculaire inappropriée. Pour prévenir cela, une période de blanking ventriculaire post-auriculaire est programmée.
- Interférences électromagnétiques (EMI) : Provenant de l’environnement (portiques de sécurité, bistouri électrique, IRM non compatible).
Dans la stimulation DDD, la surdétection auriculaire (ex: myopotentiels ou parasites sur la sonde A) est interprétée comme une activité auriculaire rapide, ce qui peut entraîner une stimulation ventriculaire rapide (tachycardie induite) jusqu’à la fréquence maximale de suivi.
Dans la stimulation DDI ou VVI, la surdétection entraîne une simple inhibition, risquant de provoquer une bradycardie symptomatique ou une asystolie chez le patient dépendant.
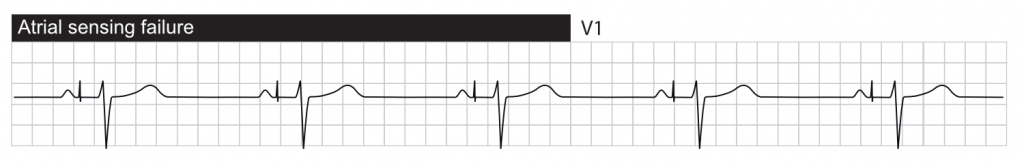
Sous-détection (Undersensing)
La sous-détection se produit lorsque le stimulateur cardiaque ne « voit » pas l’activité cardiaque spontanée (ondes P ou R). En conséquence, le stimulateur fonctionne en mode asynchrone (fixe), délivrant des impulsions indépendamment du rythme intrinsèque du patient.
Cela peut être dû à :
- Une amplitude insuffisante du signal intrinsèque (ex: cardiomyopathie, fibrose, extrasystoles ventriculaires de faible amplitude).
- Une sensibilité programmée trop basse (valeur numérique en mV trop élevée).
- Un déplacement de sonde ou une rupture de l’isolant (baisse de l’impédance et du signal).
On parle de sous-détection fonctionnelle lorsque le stimulateur cardiaque ne détecte pas l’activité intrinsèque car celle-ci tombe dans une période réfractaire programmée (ex: PVARP). Il s’agit d’un comportement normal pour éviter de réagir à des événements inappropriés.
La sous-détection présente un risque arythmique majeur. Si un spike ventriculaire tombe sur l’onde T d’un battement spontané non détecté (phénomène R-sur-T), cela peut déclencher une tachycardie ventriculaire ou une fibrillation ventriculaire.
Tachyarythmies associées au stimulateur
Le stimulateur peut être impliqué dans la genèse ou le maintien de tachyarythmies, principalement en mode double chambre (DDD) :
Tachycardie par réentrée électronique (PMT)
Si l’impulsion ventriculaire parvient à remonter de manière rétrograde vers les oreillettes (conduction VA intacte), elle génère une onde P rétrograde. Si cette onde P tombe en dehors de la période réfractaire auriculaire post-ventriculaire (PVARP), elle est détectée par la sonde auriculaire, ce qui déclenche un nouveau délai AV et une nouvelle stimulation ventriculaire. Ce cycle se perpétue, créant une tachycardie en boucle sans fin (Endless Loop Tachycardia).
La PMT tourne généralement à la fréquence maximale de suivi (Upper Tracking Limit). Elle peut être interrompue en appliquant un aimant sur le boîtier, ce qui force le passage en mode asynchrone (DOO ou VOO) et rompt la boucle de détection. Les algorithmes modernes allongent automatiquement la PVARP après une extrasystole ventriculaire (PVC) pour prévenir ce phénomène.
Suivi des tachyarythmies supraventriculaires
Une tachyarythmie supraventriculaire (comme une fibrillation auriculaire ou un flutter) peut être transmise aux ventricules si le stimulateur est en mode DDD. Le stimulateur tente de synchroniser chaque onde auriculaire rapide avec une stimulation ventriculaire. Le Repli automatique (Mode Switch) est une fonction essentielle qui bascule le stimulateur en mode non-P-synchronisé (DDI ou VDI) dès qu’une fréquence auriculaire pathologique est détectée.
Emballement du stimulateur (Runaway Pacemaker)
L’emballement d’un stimulateur cardiaque est une défaillance matérielle rare mais gravissime où le générateur délivre des impulsions à très haute fréquence (jusqu’à 200-400 bpm), pouvant induire une fibrillation ventriculaire. Cela est souvent dû à un endommagement des circuits internes par irradiation thérapeutique ou électrocution externe. Le traitement d’urgence nécessite l’application d’un aimant ou une intervention chirurgicale immédiate pour déconnecter les sondes.
Pseudo-dysfonctionnements à connaître
Certains aspects de l’ECG peuvent ressembler à des dysfonctionnements mais sont en réalité des comportements normaux programmés :
- Hystérésis de fréquence : Pour favoriser le rythme spontané, le stimulateur peut autoriser la fréquence cardiaque à descendre en dessous de la fréquence de base (ex: 50 bpm pour une base à 60 bpm) avant de reprendre la stimulation. Cela ne doit pas être confondu avec une pause anormale.
- Stimulation de sécurité ventriculaire (Ventricular Safety Pacing – VSP) : Si un événement est détecté sur le canal ventriculaire très peu de temps après une stimulation auriculaire (dans la fenêtre de crosstalk, ex: 110ms), le stimulateur délivre systématiquement une impulsion ventriculaire précoce pour prévenir une inhibition par diaphonie. Cela crée un aspect de délai AV très court sur l’ECG.
Conduite à tenir face à une suspicion de dysfonctionnement
Face à un patient porteur de stimulateur présentant des symptômes (syncope, palpitations) ou des anomalies ECG, une approche systématique est requise :
- ECG 12 dérivations : Rechercher la présence et la morphologie des spikes. Un changement d’axe du spike ou du QRS stimulé peut indiquer un déplacement de sonde.
- Test à l’aimant : L’application d’un aimant sur le boîtier ferme un interrupteur magnétique (REED switch). Le stimulateur passe en mode asynchrone (VOO/DOO) à une fréquence spécifique (fréquence magnétique).
- Si la capture est rétablie sous aimant : le problème initial était probablement une surdétection.
- Si l’absence de capture persiste sous aimant : le problème est un défaut de capture (seuil trop haut, sonde déplacée).
- La fréquence sous aimant indique également l’état de la batterie (une baisse de fréquence signale souvent l’ERI).
- Radiographie thoracique : Vérifier l’intégrité des sondes (rechercher une fracture claviculaire, le syndrome de Twiddler ou un déplacement de l’extrémité).
- Interrogation du dispositif : C’est l’étape définitive. Le programmateur permet de mesurer les impédances, les seuils de détection et de stimulation, et de consulter les mémoires (histogrammes, épisodes d’arythmie enregistrés).