Il est communément admis qu’environ 80 % des arrêts cardiaques sont causés par une maladie coronarienne aiguë ou chronique, cette dernière étant la plus fréquente. Ce chiffre de 80 % figure encore dans la plupart des manuels classiques sur le sujet. Cependant, les données épidémiologiques contemporaines et les registres nationaux suggèrent que le chiffre actuel est plus proche de 60 %. L’écart entre les chiffres traditionnels et les études récentes s’explique en partie par la diminution spectaculaire de l’incidence des syndromes coronariens aigus (SCA) et de la mortalité cardiovasculaire associée au cours des dernières décennies, grâce à une meilleure prévention primaire et secondaire. En outre, la revascularisation précoce des syndromes coronariens aigus (STEMI, NSTEMI, angor instable) par angioplastie primaire a considérablement augmenté, ce qui a entraîné une diminution du nombre d’arrêts cardiaques ischémiques provoqués par ces pathologies (Jerkeman et al.). Parallèlement, la proportion d’arrêts cardiaques survenant sur des rythmes non choquables (asystolie, activité électrique sans pouls) a augmenté, reflétant une population de patients plus âgée avec des comorbidités non cardiaques plus lourdes.
Il est souvent difficile de déterminer avec certitude la cause d’un arrêt cardiaque survenu hors de l’hôpital (ACEH), l’événement étant par définition soudain et souvent sans témoins. Les autopsies sont fortement recommandées lorsque la cause sous-jacente est inconnue, en particulier chez les sujets jeunes (< 40 ans) pour dépister des causes génétiques familiales. Cependant, les autopsies ne sont souvent pas pratiquées systématiquement en raison de contraintes logistiques et de leur coût élevé. Les difficultés rencontrées pour déterminer la cause d’un arrêt cardiaque extrahospitalier se reflètent dans la classification recommandée par les lignes directrices internationales d’Utstein (tableau 1). Les grandes catégories de causes sont jugées nécessaires en raison des incertitudes qui prévalent dans le contexte préhospitalier (Perkins et al.). La figure 1 présente les données du registre suédois des arrêts cardiaques, qui a enregistré les causes des arrêts cardiaques avec une catégorie distincte pour les étiologies cardiaques.
| Cause | Définition |
|---|---|
| Cause médicale | Comprend les arrêts cardiaques causés par une maladie cardiaque (ischémique, structurelle, électrique), d’autres conditions médicales (embolie pulmonaire, hémorragie massive, accident vasculaire cérébral, rupture d’anévrisme, etc.) ainsi que les cas où la cause n’entre pas dans les autres catégories traumatiques ou toxiques. |
| Traumatisme | Arrêt cardiaque provoqué par des violences, des accidents de la voie publique, des chutes, des brûlures ou d’autres traumatismes directs. |
| Noyade | Arrêt cardiaque hypoxique dû à la submersion/noyade. |
| Électrocution | Arrêt cardiaque dû au passage d’un courant électrique à travers le cœur (effet arythmogène direct type FV). |
| Asphyxie | Asphyxie due à des causes externes, par exemple obstruction des voies aériennes par un corps étranger, pendaison ou strangulation. |
| Surdose de médicaments / Toxique | Surdose intentionnelle ou accidentelle de médicaments, de drogues illicites (opioïdes, cocaïne) ou d’autres substances (y compris l’alcool) provoquant un arrêt cardiaque par dépression respiratoire ou effet cardiotoxique direct. |
Étiologie cardiaque et mécanismes physiopathologiques
Les arrêts cardiaques provoqués par des conditions et des événements cardiovasculaires sont des événements hautement stochastiques (aléatoires). Cela est dû au fait que la grande majorité de ces arrêts, lorsqu’ils sont d’origine cardiaque, sont causés par des arythmies ventriculaires malignes (tachycardie ventriculaire, fibrillation ventriculaire), dont l’occurrence est imprévisible. Cela ressort clairement du fait que la grande majorité des infarctus du myocarde et des épisodes d’ischémie myocardique ne provoquent pas d’arythmies ventriculaires soutenues ni d’arrêts cardiaques. Il est établi que seule une fraction négligeable de tous les épisodes d’ischémie myocardique entraîne une mort subite.
Pour qu’un infarctus ou un épisode ischémique entraîne une arythmie ventriculaire, il doit coïncider avec d’autres facteurs pro-arythmogènes, un concept souvent décrit par le Triangle de Coumel. L’émergence d’une tachycardie ou d’une fibrillation ventriculaire est donc le résultat d’un scénario de tempête parfaite nécessitant la réunion de trois éléments :
- Le substrat arythmogène : Une anomalie structurelle (cicatrice d’infarctus, fibrose, cardiomyopathie) ou électrique (canalopathie) préexistante.
- Le facteur gâchette (trigger) : Un événement déclencheur, souvent une extrasystole ventriculaire (ESV) précoce (phénomène R sur T).
- Les facteurs modulants : L’environnement physiologique momentané, incluant le système nerveux autonome (balance sympathique/parasympathique), l’ischémie aiguë, les troubles électrolytiques (hypokaliémie), l’étirement myocardique (hémodynamique).
Ces facteurs interagissent et varient dans le temps. Certains facteurs varient d’une seconde à l’autre (par exemple, le degré d’ischémie, le tonus parasympathique et sympathique) tandis que d’autres mettent des mois ou des années à se développer (par exemple, le remodelage du myocarde dans l’insuffisance cardiaque ou après un infarctus du myocarde).
Les arythmies ventriculaires sont plus faciles à induire en présence de substrats arythmogènes anatomiques. Un substrat est défini comme un facteur physiologique ou anatomique qui peut déclencher ou entretenir des arythmies, comme le tissu cicatriciel et hétérogène après un infarctus du myocarde, favorisant les circuits de réentrée (voir Mécanismes des arythmies cardiaques).
Il est souvent difficile de clarifier le mécanisme exact à l’origine de l’arrêt cardiaque, même si un substrat est connu. Un patient atteint d’une cardiomyopathie ischémique peut avoir plusieurs substrats – par exemple, du tissu nécrotique dans le myocarde, une insuffisance cardiaque avec dilatation et remodelage du myocarde, et des épisodes répétés d’ischémie dus à des sténoses de l’artère coronaire – ce qui rend difficile la détermination du facteur déclenchant exact.
Syndromes coronariens chroniques et aigus
La maladie coronarienne reste la cause prédominante de la mort subite cardiaque chez l’adulte.
- L‘ischémie myocardique aiguë peut induire une tachycardie ventriculaire et une fibrillation ventriculaire (FV), provoquant ainsi un arrêt cardiaque. Ce phénomène peut se produire à tout moment au cours de l’évolution naturelle de la maladie coronarienne, y compris comme première manifestation inaugurale de la maladie (« mort subite inaugurale »). Le mécanisme de l’arythmie est, dans la plupart des cas, une réentrée de phase 2 ou des automatismes anormaux autour de la zone ischémique.
- L‘infarctus aigu du myocarde (avec nécrose constituée) peut également provoquer une tachycardie ventriculaire et une fibrillation ventriculaire. Le mécanisme de l’arythmie est également la réentrée. Le risque de tachycardie ventriculaire et de fibrillation ventriculaire est le plus élevé pendant les premières minutes et les premières heures (phase pré-hospitalière), puis il diminue rapidement après l’admission et la reperfusion.
- Les occlusions chroniques totales (CTO) sont des occlusions complètes et anciennes des artères coronaires. Pratiquement toutes les CTO ont des vaisseaux collatéraux (provenant d’autres artères) qui reperfusent l’artère occluse, de sorte que le myocarde à risque peut être perfusé a minima. Cependant, le myocarde est susceptible d’avoir développé des substrats d’arythmie (par exemple, îlots de fibrose) malgré le soutien des vaisseaux collatéraux. Les vaisseaux collatéraux peuvent prévenir ou limiter les infarctus supplémentaires et permettre une fonction contractile complète au repos. Cependant, la réserve fonctionnelle des collatéraux est limitée et la grande majorité des patients atteints de CTO présentent des symptômes ischémiques à l’effort. Des études récentes montrent qu’environ 35 % des patients ayant subi un arrêt cardiaque en dehors de l’hôpital, avec un rythme initial choquable, présentent des CTO (Lemkes et al.).
- La cardiomyopathie ischémique. La cardiomyopathie ischémique se caractérise par un remodelage ventriculaire gauche, la formation de cicatrices transmurales et une insuffisance cardiaque à fraction d’éjection réduite, qui présentent un risque très élevé d’arythmies ventriculaires malignes. Les patients atteints de cardiomyopathie ischémique présentent un risque élevé d’arrêt cardiaque soudain, justifiant souvent l’implantation d’un défibrillateur automatique (DAI) en prévention primaire ou secondaire.
Parmi les patients victimes d’un arrêt cardiaque, les antécédents d’infarctus du myocarde sont nettement plus fréquents que les infarctus aigus du myocarde survenant de novo. Un infarctus antérieur (cicatrice) est observé dans 40 à 70 % de tous les arrêts cardiaques extrahospitaliers, tandis qu’un infarctus aigu ou récent est observé dans environ 20 % des cas. Dans l’étude POST-SCD, seuls 30 % des cas présentaient un syndrome coronarien aigu thrombotique à l’autopsie (Tseng et al.). Ainsi, parmi les cas où la maladie coronarienne est la cause sous-jacente de l’arrêt cardiaque, les infarctus anciens constituent la majorité des substrats.
Le risque d’arrêt cardiaque augmente avec l’étendue de l’ischémie ou de l’infarctus (masse myocardique concernée). Le risque augmente également en cas de déséquilibre électrolytique (hypokaliémie, hypomagnésémie), d’hypotension, d’hypertension, de surcharge volumétrique ventriculaire gauche et d’activation sympathique intense.
Autres causes liées aux artères coronaires
Bien que l’athérosclérose soit dominante, d’autres pathologies coronariennes peuvent mener à l’arrêt cardiaque :
- Anomalies congénitales des artères coronaires
- Des variantes congénitales dans l’origine ou le trajet des artères coronaires se produisent chez 5 % de tous les individus (Angelini et al.). Certaines variantes, notamment l’origine anormale d’une coronaire à partir du sinus opposé avec un trajet inter-artériel (entre l’aorte et l’artère pulmonaire), sont associées à un risque accru d’arrêt cardiaque soudain, en particulier lors d’un exercice physique intense chez le jeune adulte.
- Les ponts myocardiques (trajet intramyocardique d’une coronaire épicardique, prévalents chez 1 % de la population) augmenteraient le risque d’arrêt cardiaque soudain, en particulier pendant l’exercice. Les ponts entraînent une compression systolique du segment de l’artère coronaire (figure 2), pouvant générer une ischémie, bien que la perfusion coronaire soit majoritairement diastolique.
- Embolie des artères coronaires
- Embolie septique due à une endocardite infectieuse (végétations sur la valve aortique ou mitrale).
- Embolie due à des thrombus dans l’aorte proximale ou sur une prothèse valvulaire.
- Embolie paradoxale (passage d’un thrombus veineux à travers un foramen ovale perméable).
- Artérite et vascularites (inflammation des artères coronaires)
- Maladie de Kawasaki (anévrismes coronaires).
- La polyartérite noueuse (PAN).
- Artérite de Takayasu.
- Le spasme de l’artère coronaire (Angor de Prinzmetal) peut provoquer un arrêt cardiaque soudain dû à des arythmies ventriculaires sévères sur ischémie transmurale. Le risque semble plus élevé si le spasme se produit dans des artères coronaires athérosclérotiques présentant des sténoses, mais peut survenir sur des artères saines (MINOCA).
- La dissection aortique proximale (Type A) avec extension et occlusion de l’ostium coronaire (le plus souvent la coronaire droite) peut entraîner un infarctus massif inférieur et des arythmies ventriculaires ou une dissociation électromécanique par tamponnade.
- La dissection spontanée de l’artère coronaire (SCAD), touchant préférentiellement les femmes d’âge moyen, est une cause importante de SCA et d’arrêt cardiaque.

Troponine pour le diagnostic différentiel de l’arrêt cardiaque
La troponine T (TnT) et la troponine I (TnI) ultra-sensibles sont souvent analysées en cas d’arrêt cardiaque extrahospitalier afin de déterminer si l’arrêt cardiaque a été causé par un infarctus aigu du myocarde par occlusion coronaire. La logique sous-jacente est que la nécrose myocardique significative commence après environ 20 minutes d’anoxie myocardique complète. Ainsi, on pourrait théoriquement supposer que les arrêts cardiaques dus à des causes non ischémiques présenteraient de faibles taux de troponines.
Toutefois, la réalité clinique est plus complexe. Le processus de réanimation (massages cardiaques, chocs électriques) et l’ischémie globale (syndrome post-arrêt cardiaque) provoquent eux-mêmes une souffrance myocardique et une libération de troponines, indépendamment de la cause initiale. Dans une étude portant sur 145 patients ayant retrouvé une activité cardiaque spontanée (ROSC) après un arrêt cardiaque, tous les individus sans exception présentaient des taux élevés de troponine. Ces taux n’ont pas permis de distinguer avec fiabilité les arrêts cardiaques dus à un infarctus par occlusion coronaire (type 1) des autres causes (type 2 ou non ischémiques). Les taux de troponine n’étaient pas non plus corrélés de manière linéaire avec la survie ou la fonction ventriculaire gauche résiduelle(Agusala et al.). Par conséquent, la décision de réaliser une coronarographie urgente ne doit pas reposer uniquement sur la troponine, mais sur l’ECG (présence d’un sus-décalage du segment ST) et le contexte clinique.
Lecture suggérée : Troponine cardiaque I (TnI) et T (TnT) : Interprétation et évaluation dans les syndromes coronariens aigus
Hypertrophie ventriculaire et cardiomyopathie hypertrophique
L’hypertrophie ventriculaire gauche (HVG) est un substrat arythmogène majeur.
Tous les types d’hypertrophie, indépendamment de leur étiologie et de leur localisation, augmentent le risque d’arythmie ventriculaire et d’arrêt cardiaque soudain. La cause la plus fréquente d’hypertrophie ventriculaire dans la population générale est l’hypertension artérielle mal contrôlée (cardiopathie hypertensive). L’hypertension étant également un facteur de risque majeur de maladie coronarienne, ces patients présentent souvent un cumul de risques : hypertrophie (substrat) et ischémie (gâchette). De plus, l’HVG s’accompagne souvent de fibrose interstitielle qui favorise les circuits de réentrée.
La cardiomyopathie hypertrophique (CMH) est une cardiomyopathie génétique (prévalence 1/500) définie par une hypertrophie ventriculaire gauche inexpliquée par les conditions de charge. L’hypertrophie est généralement asymétrique, touchant souvent le septum. En cas d’hypertrophie septale importante, une obstruction dynamique de la chambre de chasse du ventricule gauche peut se produire, définissant la forme obstructive (HOCM). La CMH est la cause la plus fréquente d’arrêt cardiaque soudain chez les athlètes de moins de 35 ans. Dans ce contexte, l’arrêt cardiaque n’est généralement pas dû à l’obstruction hémodynamique elle-même, mais à des arythmies ventriculaires (TV/FV) survenant sur un myocarde désorganisé (disarray myocytaire) et fibreux.
L’hypertrophie est un facteur de risque indépendant d’arythmie. Le risque est corrélé à l’épaisseur maximale de la paroi (> 30 mm est un facteur de risque majeur), à la présence de TV non soutenues au Holter, et aux antécédents de syncope inexpliquée.
Cardiomyopathies structurelles
Toutes les cardiomyopathies comportent un risque de mort subite par arythmie, souvent avant le stade terminal de l’insuffisance cardiaque.
Chez les patients souffrant d’insuffisance cardiaque chronique avec fraction d’éjection réduite (HFrEF), environ 50 % des décès sont des morts subites (le reste étant des décès par défaillance de pompe progressive) (Packer et al.). Plus la fraction d’éjection est faible, plus le risque absolu de mortalité est élevé. C’est pourquoi l’implantation d’un défibrillateur est recommandée lorsque la FEVG est ≤ 35 % malgré un traitement médical optimal. La majorité des morts subites dans l’insuffisance cardiaque sont causées par des tachyarythmies ventriculaires. Une minorité est causée par des bradyarythmies ou une dissociation électromécanique.
- Cardiomyopathie dilatée (CMD) : D’origine génétique (ex: mutation lamine A/C à haut risque arythmique), toxique, ou idiopathique. Le risque d’arythmie est lié à la fibrose de remplacement.
- Cardiomyopathie restrictive (RCM) : Plus rare, associée à une dilatation bi-auriculaire massive favorisant aussi les arythmies supraventriculaires.
- Cardiomyopathie alcoolique : Forme de CMD potentiellement réversible à l’arrêt de l’intoxication.
- Cardiomyopathie du péripartum : Peut se compliquer d’arrêt cardiaque dans les mois suivant l’accouchement.
Cardiomyopathie ventriculaire droite arythmogène (CVDA)
La cardiomyopathie ventriculaire droite arythmogène (CVDA/ARVC) est une maladie génétique des desmosomes, caractérisée par le remplacement fibro-adipeux du myocarde, prédominant au ventricule droit (le « triangle de la dysplasie »). Elle augmente considérablement le risque d’arythmies ventriculaires (TV monomorphe souvent retard gauche, FV) et de mort cardiaque subite, particulièrement chez le sujet jeune et sportif. L’exercice physique intense accélère la progression de la maladie et favorise les arythmies (« cardiomyopathie induite par l’exercice » chez les porteurs de mutation). La syncope est un signe d’alarme majeur.
Insuffisance cardiaque aiguë
L’insuffisance cardiaque aiguë (OAP, choc cardiogénique) crée un environnement pro-arythmique majeur : hypoxie, acidose, catécholamines endogènes et exogènes (inotropes), et étirement mécanique des fibres myocardiques. Le risque d’arrêt cardiaque est immédiat, soit par arythmie ventriculaire, soit par épuisement de pompe (bradycardie terminale et asystolie).
Causes inflammatoires et infiltratives
- Myocardites : Qu’elles soient virales (parvovirus B19, entérovirus, COVID-19) ou auto-immunes, les myocardites aiguës peuvent se compliquer d’arythmies ventriculaires à la phase aiguë en raison de l’inflammation et de l’œdème, ou à long terme à cause des cicatrices. La myocardite à cellules géantes est une forme fulminante à très haut risque de décès arythmique ou hémodynamique.
- Sarcoïdose cardiaque : Une atteinte cardiaque cliniquement manifeste survient chez 5 à 10 % des patients atteints de sarcoïdose (mais jusqu’à 25% à l’autopsie). Les granulomes créent des foyers d’automatisme et des blocs de conduction. La tachycardie ventriculaire et le bloc AV complet sont fréquents (Ekström et al.).
- Amylose cardiaque : L’infiltration amyloïde (AL ou ATTR) épaissit les parois et perturbe la conduction. Le risque principal est la dissociation électromécanique (cœur rigide, bas débit) et les blocs de conduction, bien que les arythmies ventriculaires soient aussi possibles.
Cardiopathie valvulaire
Les lésions valvulaires, en modifiant l’hémodynamique et la structure ventriculaire, prédisposent à l’arrêt cardiaque.
- Sténose aortique (RA) : Le rétrécissement aortique serré symptomatique comporte un risque de mort subite (environ 1 % par an chez l’asymptomatique, beaucoup plus dès l’apparition des symptômes : angor, syncope, dyspnée). Le mécanisme est souvent une hypotension brutale à l’effort activant des réflexes barorécepteurs paradoxaux, ou une arythmie ventriculaire sur un ventricule hypertrophié.
- Prolapsus valvulaire mitral (PVM) : Généralement bénin, il existe un sous-groupe à risque (« PVM malin » ou « arythmogène »), caractérisé par une fibrose des muscles papillaires, des ondes T inversées en inférieur, et des TV complexes.
- Disjonction Annulaire Mitrale (MAD) : Une séparation anormale entre la jonction auriculo-ventriculaire et l’attache du feuillet mitral postérieur, souvent associée au PVM, est un substrat arythmogène nouvellement reconnu (Bennett et al.).
- Endocardite infectieuse : L’endocardite entraîne rarement des arythmies ventriculaires primaires. Toutefois, un abcès de l’anneau peut provoquer un bloc AV complet soudain. Les embolies coronaires septiques sont une autre cause d’arrêt cardiaque.
Causes vasculaires pulmonaires et embolie pulmonaire
L’Embolie Pulmonaire (EP) massive est une cause fréquente d’arrêt cardiaque non arythmique (environ 5 à 10 % des ACEH). L’obstruction brutale de l’artère pulmonaire entraîne une défaillance aiguë du ventricule droit, une chute du prépaiement ventriculaire gauche et un choc obstructif. L’arrêt cardiaque se présente typiquement par une Activité Électrique Sans Pouls (AESP). Le diagnostic est difficile en per-arrêt cardiaque mais doit être évoqué devant des antécédents de thrombose veineuse profonde (TVP), une chirurgie récente ou un cancer. La thrombolyse systémique peut être envisagée en cours de réanimation si la suspicion est forte.
Déséquilibres électrolytiques et causes métaboliques
Les troubles ioniques sont des causes réversibles majeures d’arrêt cardiaque, faisant partie des « 5 H » (voir ci-dessous).
- Hyperkaliémie : Fréquente chez l’insuffisant rénal. Elle entraîne un élargissement du QRS, des ondes T pointues, une bradycardie sinusoïdale puis sinu-ventriculaire, évoluant vers l’asystolie ou la FV (« sinusoïde »). C’est une urgence vitale nécessitant du calcium, de l’insuline-glucose et du bicarbonate.
- Hypokaliémie et Hypomagnésémie : Favorisent l’hyperexcitabilité ventriculaire, les torsades de pointes et la FV, particulièrement chez les patients sous diurétiques.
Défauts de conduction (Blocs auriculo-ventriculaires)
Le bloc auriculo-ventriculaire (BAV) complet est une cause classique mais moins fréquente d’arrêt cardiaque soudain que les tachyarythmies. La défaillance du nœud sinusal ou du nœud AV entraîne l’émergence d’un rythme d’échappement subsidiaire. Si le bloc est nodal, l’échappement jonctionnel est généralement stable. Si le bloc est infra-hissien (bloc AV complet sur BBG/BBD), le rythme d’échappement ventriculaire est lent, instable et peut s’arrêter à tout moment (syncope d’Adams-Stokes) ou dégénérer en torsades de pointes en raison de la bradycardie.
La préexcitation ventriculaire (syndrome de Wolff-Parkinson-White, WPW) présente un mécanisme spécifique de mort subite : la « fibrillation auriculaire pré-excitée ». Si la voie accessoire a une période réfractaire courte (< 250 ms), elle peut conduire la fibrillation auriculaire au ventricule à une fréquence extrêmement élevée (> 300 bpm), dégénérant immédiatement en fibrillation ventriculaire.
Canalopathies et troubles du rythme héréditaires
Ces affections purement électriques surviennent sur un cœur structurellement sain (« autopsie blanche »).
Syndrome du QT long (SQTL)
Le syndrome du QT long (LQTS) est un trouble de la repolarisation cardiaque caractérisé par un allongement de l’intervalle QT sur l’ECG de surface (QTc > 450-480 ms). Cet allongement favorise les post-dépolarisations précoces (EADs) qui déclenchent des tachycardies ventriculaires polymorphes spécifiques appelées Torsades de Pointes. Ces torsades causent des syncopes ou dégénèrent en fibrillation ventriculaire.
- LQTS Congénital : Maladie génétique.
- LQT1 (KCNQ1) : Le plus fréquent. Les événements surviennent typiquement à l’effort physique (notamment la natation) et lors d’émotions. L’onde T est large.
- LQT2 (KCNH2) : Les événements sont déclenchés par des stimuli auditifs soudains (réveil, téléphone), le stress émotionnel ou le post-partum. L’onde T est bifide ou de faible amplitude.
- LQT3 (SCN5A) : Les événements surviennent typiquement au repos ou pendant le sommeil (bradycardie). L’onde T est tardive avec un segment ST isoélectrique long.
- LQTS Acquis : Beaucoup plus fréquent, induit par des médicaments (antibiotiques macrolides, antipsychotiques, antiarythmiques de classe Ia et III, etc.) souvent en association avec une hypokaliémie ou une bradycardie. Voir la Liste des médicaments causant le syndrome du QT long.
Syndrome du QT court (SQTS)
Maladie génétique très rare (gain de fonction des canaux potassiques) avec un QTc < 330-340 ms. Le risque de fibrillation auriculaire et ventriculaire est très élevé, même chez le jeune enfant.
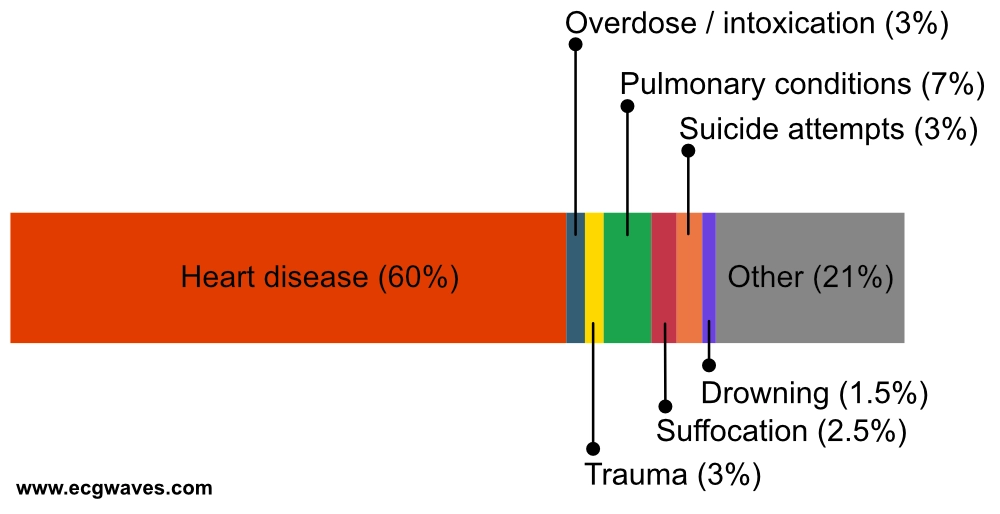
Le syndrome de Brugada
Canalopathie sodique (perte de fonction SCN5A dans 20-30% des cas) prédisposant à la FV. Typique chez l’homme jeune (30-40 ans), les arythmies surviennent souvent la nuit (tonus vagal) ou lors d’états fébriles. Le diagnostic repose sur l’aspect ECG de type 1 spontané ou induit (sus-décalage du segment ST en dôme ≥ 2 mm dans les dérivations précordiales droites V1-V2 suivi d’une onde T négative). Le « type 2 » et « type 3 » (aspect en selle) ne sont pas diagnostiques seuls.
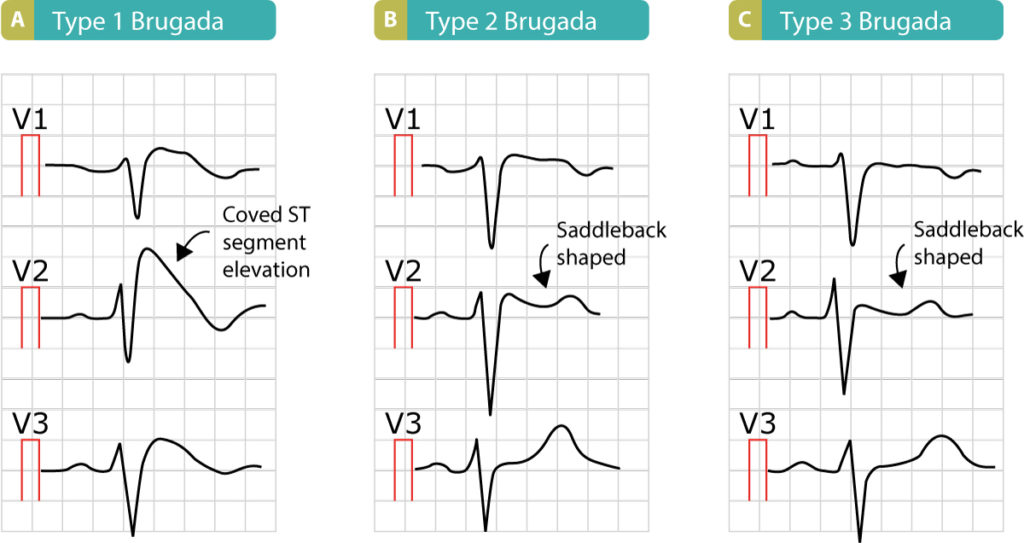
Syndrome de repolarisation précoce
Longtemps considérée bénigne, la repolarisation précoce (élévation du point J ≥ 1 mm dans 2 dérivations contiguës) en particulier dans les dérivations inférieures (II, III, aVF) et latérales, associée à un segment ST horizontal ou descendant, est liée à un risque accru de FV idiopathique (« Syndrome de l’onde J »).
Tachycardie ventriculaire polymorphe catécholaminergique (TVPC / CPVT)
Maladie héréditaire (mutation du récepteur à la Ryanodine RyR2) affectant la régulation du calcium intracellulaire. Elle provoque des TV polymorphes ou bidirectionnelles typiques lors de l’effort ou d’émotions fortes chez l’enfant ou l’adolescent, sur un cœur structurellement sain et un ECG de repos strictement normal. C’est une cause majeure de mort subite chez l’enfant.
Les Causes Réversibles : La Règle des « 5 H et 5 T »
Dans la prise en charge clinique de l’arrêt cardiaque, il est crucial d’identifier et de traiter les causes réversibles immédiates, souvent mémorisées par l’acronyme « 5H et 5T ». Bien que certaines aient été détaillées ci-dessus, cette synthèse est essentielle pour le clinicien :
- 5 H :
- Hypovolémie (hémorragie, déshydratation sévère).
- Hypoxie (noyade, obstruction voies aériennes, pneumonie).
- Hydrogène (Acidose).
- Hyperkaliémie / Hypokaliémie (troubles métaboliques).
- Hypothermie (accidentelle).
- 5 T :
- Tablettes/Toxines (surdosage médicamenteux, drogues).
- Tamponnade cardiaque (traumatique ou médicale, à drainer d’urgence).
- Tension (Pneumothorax sous tension, cause compressive).
- Thrombose coronaire (SCA, infarctus).
- Thrombose pulmonaire (Embolie pulmonaire).
Autres étiologies spécifiques
- Cardiomyopathie de Takotsubo : Syndrome de « cœur brisé » mimant un infarctus, déclenché par un stress intense. Bien que le pronostic soit généralement favorable avec récupération ad-integrum, la phase aiguë comporte un risque d’arythmies ventriculaires, de rupture cardiaque et de choc.
- Commotio cordis : Arrêt cardiaque par fibrillation ventriculaire déclenché par un impact thoracique direct, non pénétrant, survenant à un moment critique du cycle cardiaque (sur l’onde T, phase vulnérable). Typique dans les sports de balle (baseball, hockey) chez les jeunes.
- Causes neurologiques : L’hémorragie sous-arachnoïdienne massive peut entraîner des changements ECG profonds (« ondes T cérébrales », allongement QT) et un arrêt cardiaque par sidération myocardique neurogène ou arythmie.
- Syndrome de mort subite du nourrisson (MSN) : Décès inattendu < 1 an. Jusqu'à 10-15% des cas pourraient être dus à des canalopathies cardiaques (LQTS, CPVT) non diagnostiquées ("autopsie moléculaire").
Références
Sadie Bennett, Ritu Thamman, Timothy Griffiths, Cheryl Oxley, Jamal Nasir Khan, Thanh Phan, Ashish Patwala, Grant Heatlie, Chun Shing Kwok. Disjonction annulaire mitrale : Une revue systématique de la littérature. Sadie Bennett. Echocardiography. 2019 Aug;36(8):1549-1558.
Vaduganathan M, Patel R.B, Michel A, et al. Mode de décès dans l’insuffisance cardiaque avec fraction d’éjection préservée. J Am Coll Cardiol. 2017;69:556-569.
Ekstrom K, Lehtonen J, Nordenswan H.K, et al. Sudden death in cardiac sarcoidosis: an analysis of nationwide clinical and cause-of-death registries. Eur Heart J. 2019;40:3121-3128.
Finocchiaro G, Papadakis M, Robertus J.L, et al. Etiologie de la mort subite dans le sport : aperçu d’un registre régional du Royaume-Uni. J Am Coll Cardiol. 2016;67:2108-2115.
Minners J, Rossebo A, Chambers J.B, et al. Sudden cardiac death in asymptomatic patients with aortic stenosis. Heart. 2020;106:1646-1650
Urena M, Webb J.G, Eltchaninoff H, et al. Late cardiac death in patients undergoing transcatheter aortic valve replacement : incidence and predictors of advanced heart failure and sudden cardiac death. J Am Coll Cardiol. 2015;65:437-448.
Fulton B.L, Liang J.J, Enriquez A, et al. Imaging characteristics of papillary muscle site of origin of ventricular arrhythmias in patients with mitral valve prolapse. J Cardiovasc Electrophysiol. 2018;29:146-153.
Myerburg R.J. Variations physiologiques, facteurs environnementaux et modifications génétiques dans les syndromes LQT héréditaires. J Am Coll Cardiol. 2015;65:375-377.
Sollazzo F, Palmieri V, Gervasi S.F, et al. Sudden cardiac death in athletes in Italy during 2019 : Internet-based epidemiological research. Medicina (Kaunas). 2021;57.
Tseng Z.H, Olgin J.E, Vittinghoff E, et al. Prospective countywide surveillance and autopsy characterization of sudden cardiac death : post SCD study. Circulation. 2018;137:2689-2700.
Coronary Artery Anomalies: An Entity in Search of an Identity Paolo Angelini Originally published 13 Mar 2007 https://doi.org/10.1161/CIRCULATIONAHA.106.618082. Circulation. 2007;115:1296-1305