La physiologie de la réanimation cardio-pulmonaire (RCP)
Les forces qui régissent la perfusion coronarienne et cérébrale ainsi que la ventilation des poumons pendant la réanimation cardiopulmonaire (RCP) diffèrent considérablement de la physiologie circulatoire normale. L’objectif fondamental de la réanimation cardiopulmonaire est de générer un débit sanguin artificiel par des variations cycliques de la pression intrathoracique et par la compression directe du cœur. Ces manœuvres, consistant à comprimer, décompresser et ventiler, permettent au sang artériel oxygéné de circuler dans les réseaux vasculaire pulmonaire, coronaire et cérébral.
Deux théories principales expliquent le flux sanguin pendant la RCP : la théorie de la pompe cardiaque (compression directe du cœur entre le sternum et le rachis éjectant le sang) et la théorie de la pompe thoracique (l’augmentation globale de la pression intrathoracique propulse le sang hors du thorax). Selon la mécanique appliquée et les caractéristiques du patient, ces deux mécanismes contribuent de manière variable au débit généré. Malgré un grand nombre d’études expérimentales et d’observation menées pour optimiser l’efficacité de la RCP, il persiste des zones d’ombre, certains éléments critiques des lignes directrices (comme le ratio compression/ventilation ou la profondeur exacte) reposant majoritairement sur des données d’observation. Avec les stratégies actuelles, des compressions thoraciques de haute qualité génèrent un débit cardiaque équivalent à seulement 15-25 % du débit normal (Duggal et al.). Ce débit, bien que faible, est crucial pour préserver la viabilité cellulaire et, associé à la défibrillation précoce, permet de réanimer 10 à 15 % des arrêts cardiaques extrahospitaliers (OHCA) et 30 à 40 % des arrêts cardiaques intrahospitaliers (IHCA ; Jerkeman et al.).
Les directives actuelles de l’ILCOR et de l’AHA/ERC recommandent une profondeur de compression de 5-6 cm à un rythme de 100-120 compressions par minute (Figure 1). Ces recommandations visent à optimiser le compromis entre un débit suffisant et la protection des structures thoraciques, basées sur des registres et études observationnelles (Stiell et al., Idris et al., Duval et al.), en l’absence de grands essais cliniques randomisés définitifs sur ces paramètres spécifiques.
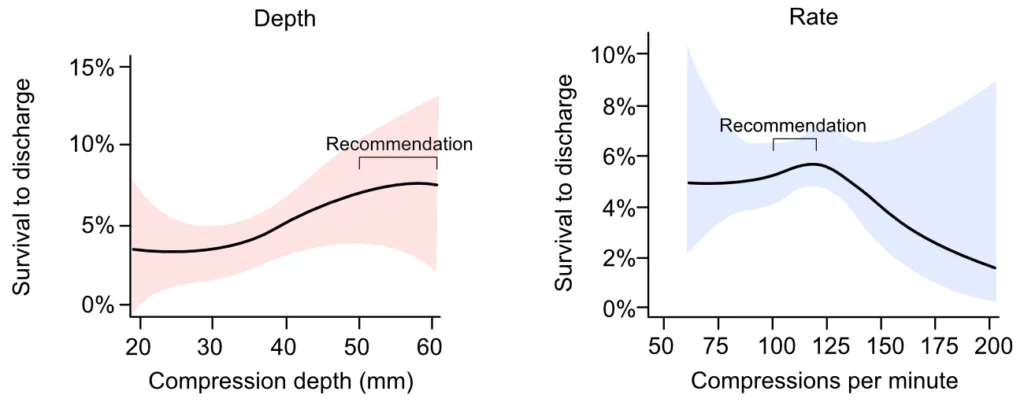
Duval et al. ont analysé 3 643 cas d’arrêt cardiaque extrahospitalier dans le cadre de l’essai ROC PRIMED. Ces patients ont été enrôlés dans une étude évaluant l’efficacité d’un adjuvant à la RCP tout en enregistrant précisément les paramètres biomécaniques. Les auteurs ont identifié un « point idéal » hémodynamique : une combinaison de 107 compressions par minute avec une profondeur de 4,7 cm. Cette combinaison s’est avérée cohérente quels que soient l’âge, le sexe, le rythme initial et l’utilisation d’accessoires de RCP, soulignant l’importance de la qualité technique du massage cardiaque externe (MCE).
Physiopathologie de la défibrillation
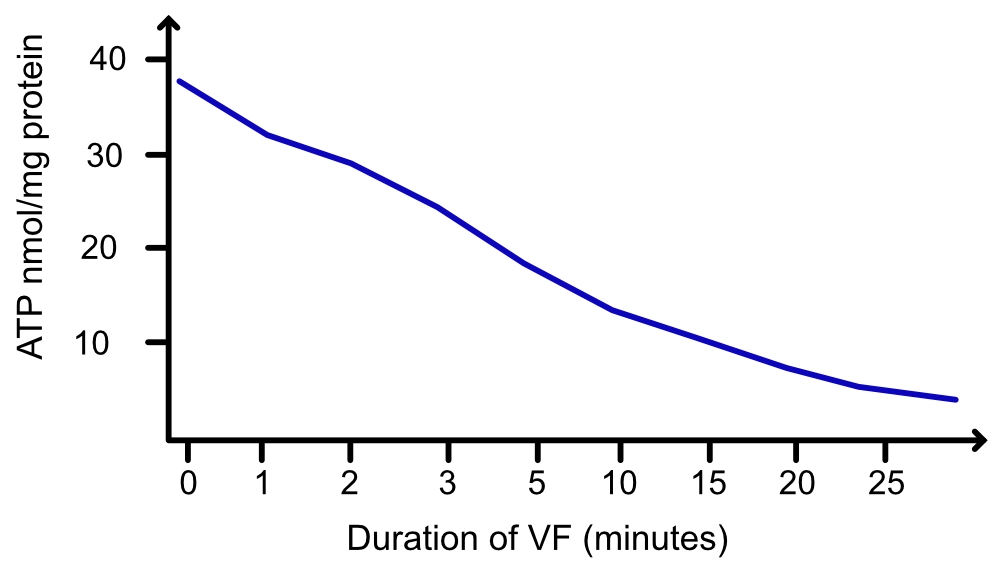
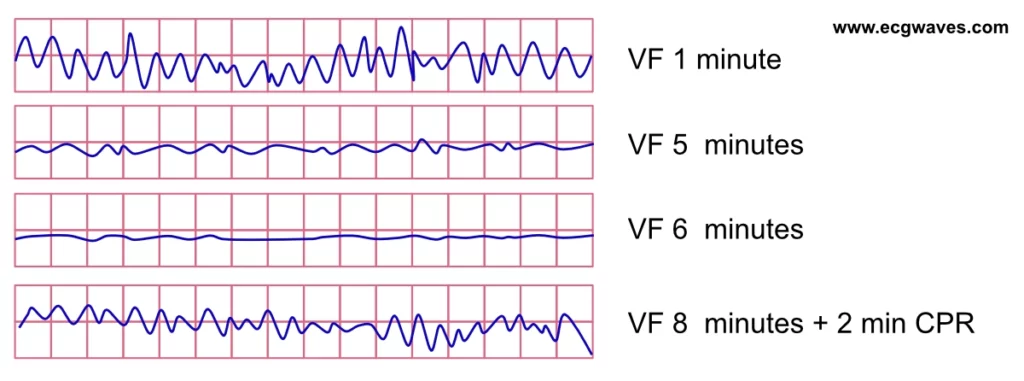
La défibrillation reste l’intervention la plus déterminante si le rythme est choquable (fibrillation ventriculaire [FV], tachycardie ventriculaire sans pouls [TV]). L’analyse de la forme d’onde de la FV fournit des indices sur la durée de l’arrêt et les réserves énergétiques du myocarde. La FV est initialement « grossière » (c’est-à-dire que les ondes fibrillatoires ont de grandes amplitudes), témoignant d’une activité électrique vigoureuse et de réserves en phosphates à haute énergie encore présentes. À mesure que la durée de la FV se prolonge sans perfusion, l’amplitude diminue progressivement ; la FV devient « fine » et finit par dégénérer en asystolie.
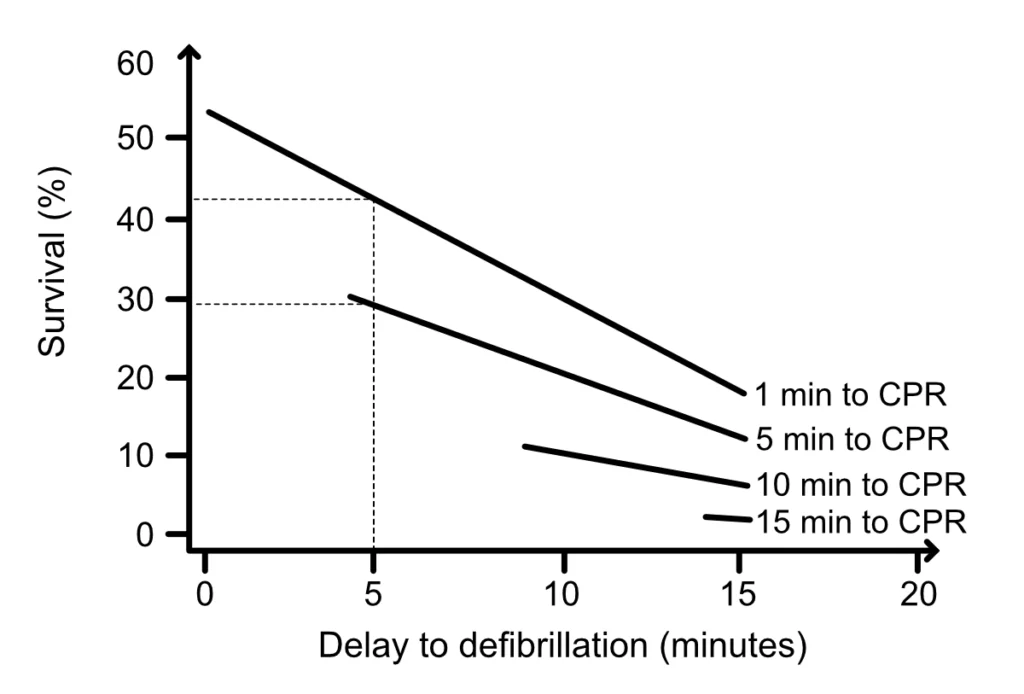
Cette progression de la FV grossière à la FV fine, puis à l’asystolie, est directement corrélée à l’épuisement de l’adénosine triphosphate (ATP) dans les cardiomyocytes. La déplétion en ATP entraîne un dysfonctionnement des pompes ioniques membranaires, rendant la cellule inexcitable et la défibrillation inefficace. La probabilité d’une défibrillation réussie est maximale en phase précoce (phase électrique), mais diminue rapidement à mesure que la forme d’onde s’affine (phase métabolique) (figures 2, 3 et 4). C’est pourquoi, dans les arrêts prolongés, une période de RCP de haute qualité avant le choc peut théoriquement « recharger » le myocarde en substrats énergétiques, bien que les preuves cliniques de cette stratégie (« choc d’abord » vs « RCP d’abord ») soient nuancées.
Hémodynamique de la RCP : Concepts avancés
En cas de rythme non choquable (asystolie, activité électrique sans pouls [AESP]) ou de périodes prolongées de FV (FV fine résistante aux chocs), l’objectif de la RCP est d’induire et de maintenir une activité électrique myocardique organisée. Le déterminant critique de ce succès est la génération d’une pression de perfusion coronarienne (PPC) adéquate. La perfusion myocardique est le prérequis absolu pour espérer un retour à une circulation spontanée (Rosc), qui est à son tour nécessaire pour sauver le cerveau.
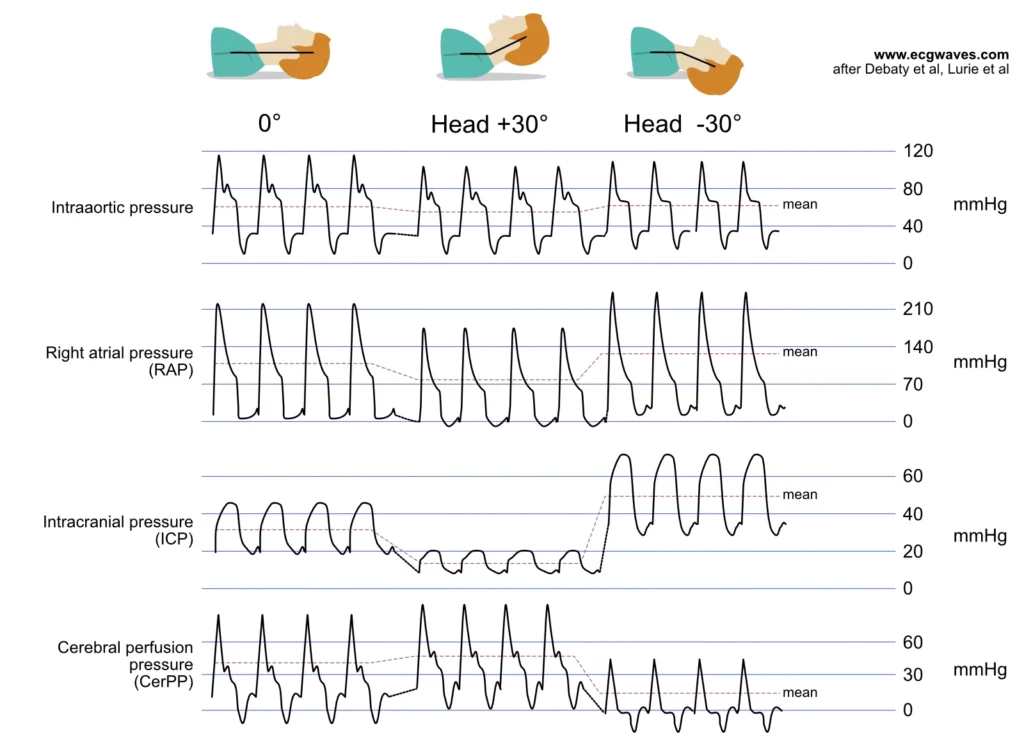
Les compressions thoraciques assurent la perfusion systémique en augmentant la pression dans les oreillettes, les ventricules et les gros vaisseaux, propulsant le sang vers l’avant. Cependant, ce mécanisme a un coût hémodynamique : les compressions augmentent simultanément la pression dans les veines intrathoraciques (veines paravertébrales, veines épidurales) et la pression intracrânienne. Comme le système veineux cérébral (jugulaires) ne possède pas de valves fonctionnelles efficaces face à ces pressions rétrogrades élevées, l’augmentation de la pression intrathoracique se transmet au cerveau. Cela élève la pression veineuse cérébrale et la pression intracrânienne (PIC), créant une force qui s’oppose au flux sanguin artériel cérébral entrant. Il s’agit d’un conflit hémodynamique majeur : comment maximiser la pression aortique sans élever excessivement la PIC ? Diverses approches (par exemple, inclinaison de la tête, dispositifs de régulation de pression intrathoracique, élévation passive des jambes) ont été évaluées pour améliorer la perfusion cérébrale en jouant sur ces gradients de pression (Debaty et al., Youcef et al.).
La phase de compression
Les compressions thoraciques réduisent brutalement le volume thoracique et augmentent la pression intrathoracique. Cette pression écrase les structures cardiaques entre le sternum et le rachis (effet pompe cardiaque) et augmente globalement la pression dans tout le thorax (effet pompe thoracique). Le sang est éjecté vers l’aorte et l’artère pulmonaire. Le bon fonctionnement des valves cardiaques (mitrale et tricuspide se fermant, aortique et pulmonaire s’ouvrant) est essentiel pour diriger ce flux de manière antérograde.
Pression de perfusion coronaire (PPC)
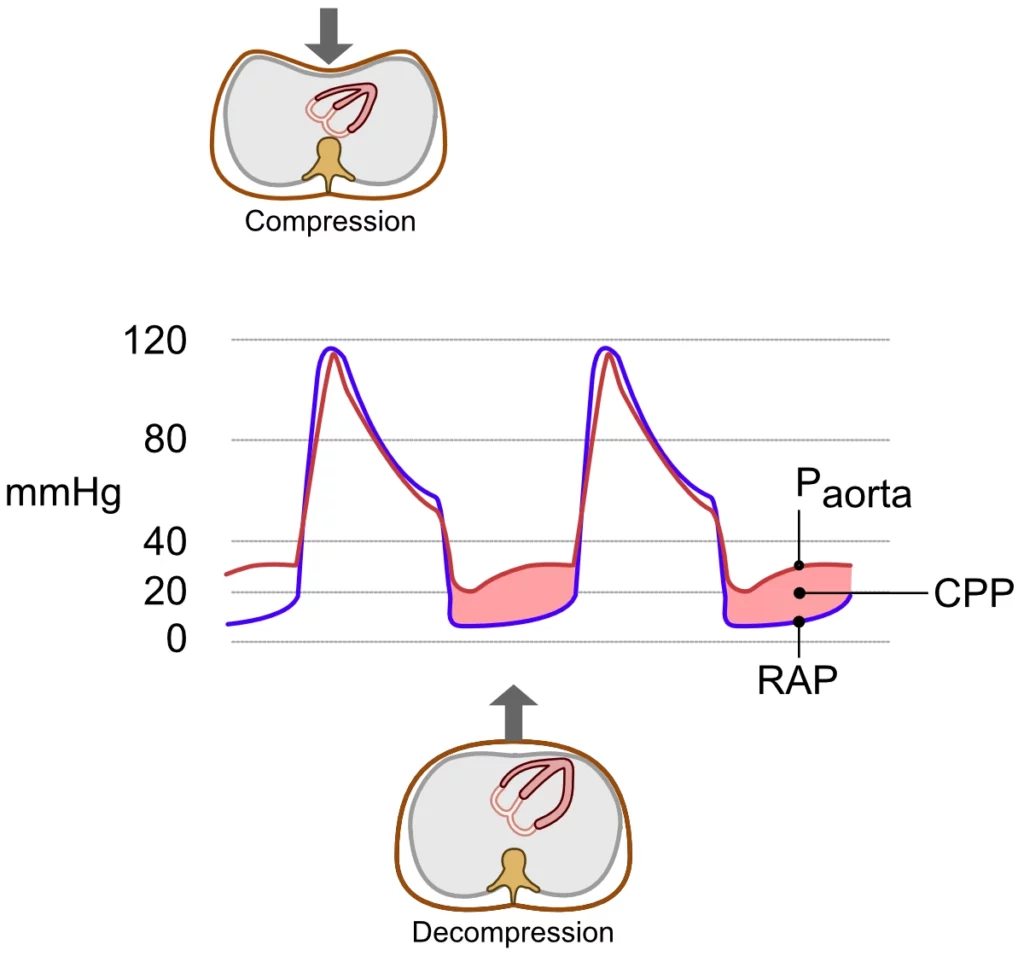
La physiologie coronaire pendant l’arrêt cardiaque est unique. Contrairement à la plupart des organes qui reçoivent du sang pendant la systole (compression), le myocarde gauche est perfusé presque exclusivement pendant la diastole (décompression). Des études séminales démontrent qu’une pression de perfusion coronaire (PPC) minimale de 15 mmHg est un seuil critique pour espérer le retour d’une circulation spontanée (ROSC) (Paradis et al.). La PPC est définie par le gradient suivant :
PPC = Pdiastolique aorte – Pdiastolique OD
Pdiastolique aorte est la pression résiduelle dans l’aorte durant la phase de relâchement
Pdiastolique OD est la pression dans l’oreillette droite (pression veineuse centrale) durant cette même phase
Pendant la phase de compression active (la « systole » de la RCP), la PPC est paradoxalement proche de 0 mmHg. En effet, la pression intramurale élevée dans le myocarde comprimé et l’augmentation simultanée de la pression dans l’oreillette droite s’opposent au flux. Le flux sanguin coronaire effectif ne se produit donc que pendant la phase de décompression (la « diastole » de la RCP).
Lorsque la compression cesse et que le thorax se relâche, la pression intrathoracique chute. Les pressions intracavitaires droites diminuent, mais la pression aortique reste relativement élevée grâce à la fermeture de la valve aortique et à l’élasticité artérielle (et à l’effet des vasopresseurs comme l’adrénaline). C’est ce gradient qui perfuse les coronaires. Une décompression incomplète ou une pression aortique diastolique insuffisante compromet donc directement la survie du myocarde (Halperin et al).
L’inertie hémodynamique est un concept clé : il faut plusieurs compressions consécutives pour « monter en pression » et atteindre une PPC efficace. De brèves interruptions (même de quelques secondes pour une analyse de rythme ou une ventilation) effondrent instantanément la PPC. Il faut ensuite environ 10 à 15 compressions ininterrompues pour rétablir le niveau de perfusion antérieur (Steen et al, Berg et al). C’est la base physiologique des recommandations insistant sur la réduction maximale des pauses (« No flow time »). Des études animales confirment que la survie diminue de manière significative pour chaque pause inutile avant la défibrillation (Cheskes et al).
Sur le plan cérébral, la phase de compression présente un risque : l’élévation de la pression veineuse jugulaire et intrathoracique se transmet à la boîte crânienne, augmentant la pression intracrânienne (PIC). Cela réduit la Pression de Perfusion Cérébrale (CerPP), définie par la différence entre la pression artérielle moyenne (PAM) et la PIC. Ainsi, bien que la compression génère une pression artérielle systémique nécessaire, elle génère simultanément une « contre-pression » veineuse nocive pour le cerveau.
La phase de décompression et le retour veineux
La phase de décompression est aussi critique que la compression elle-même. Pendant cette phase, le recul élastique (recoil) passif de la paroi thoracique crée une pression intrathoracique négative (subatmosphérique). Ce « vide » intrathoracique agit comme un aspirateur :
- Il aspire l’air dans les poumons (ventilation passive).
- Il favorise le retour veineux systémique vers le cœur droit (précharge).
- Il abaisse la pression veineuse jugulaire et la PIC, améliorant ainsi le gradient de perfusion cérébrale pour la compression suivante.
Le remplissage ventriculaire pendant la RCP est donc essentiellement passif et dépendant de ce gradient de pression négative. Si le thorax ne reprend pas sa forme initiale, ce mécanisme de pompe aspirante échoue.
L’optimisation de cette phase a conduit au développement de la décompression active. Des dispositifs mécaniques ou manuels munis de ventouses permettent de soulever activement le thorax au-delà de sa position de repos, amplifiant la pression intrathoracique négative. Cela majore le retour veineux et, par conséquent, le volume d’éjection systolique lors de la compression suivante (Plaisance et al.). Le système LUCAS, par exemple, utilise une ventouse pour stabiliser la position et potentiellement aider au recul (figure 9).

Un problème clinique fréquent est l’appui résiduel (« leaning ») sur la poitrine pendant la décompression. Le secouriste fatigué a tendance à ne pas relâcher totalement le thorax. Des études animales montrent qu’un recul incomplet de seulement 25 % (laissant 75 % d’expansion) effondre la PPC d’environ 30 % et la Pression de Perfusion Cérébrale de 50 % (Yannopoulos et al.). C’est une erreur technique fatale souvent inaperçue, présente dans plus de 90 % des réanimations manuelles non monitorées (Fried et al.).
La phase de ventilation et interactions cardio-pulmonaires
La ventilation pendant la RCP, généralement effectuée par pression positive (VPP via ballon autoremplisseur ou respirateur), inverse la physiologie respiratoire normale. Au lieu d’une pression négative inspiratoire aspirant le sang vers le cœur, la VPP crée une pression positive intrathoracique qui comprime la veine cave et l’oreillette droite, réduisant le retour veineux.
Bien que l’oxygénation soit nécessaire, la ventilation est hémodynamiquement délétère si elle est excessive. Durant les premières minutes de l’arrêt cardiaque (phase électrique et circulatoire précoce), le sang est encore relativement oxygéné et le problème principal est le débit (transport) et non le contenu en oxygène. C’est pourquoi la RCP par « compression seule » est une alternative validée pour les témoins non formés, la survie étant équivalente à la RCP standard dans les études observationnelles et randomisées sur l’OHCA (Svensson et al., Jerkeman et al.). Les compressions thoraciques elles-mêmes induisent un mouvement d’air minime mais non négligeable (McDannold et al.).
Cependant, au-delà de quelques minutes, ou en cas d’asphyxie (noyade, arrêt respiratoire primitif), la ventilation devient cruciale. Les vaisseaux pulmonaires et les alvéoles ont tendance à s’atélectasier et à s’effondrer sous l’effet des compressions répétées, augmentant la résistance vasculaire pulmonaire et surchargeant le cœur droit (Dunham-Snary et al.). Des insufflations périodiques sont nécessaires pour recruter les alvéoles et réduire cette résistance vasculaire pulmonaire (Markstaller et al.).
Le danger majeur reste l’hyperventilation. Fréquente en situation de stress, elle a trois conséquences néfastes :
- Elle maintient une pression intrathoracique moyenne élevée, empêchant le retour veineux (précharge).
- Elle provoque une vasoconstriction cérébrale par hypocapnie sévère, réduisant le débit sanguin cérébral.
- Elle dilue le surfactant et favorise les lésions pulmonaires.
Dans une étude animale classique, l’hyperventilation a réduit la PPC de 28 %, compromettant la survie (Aufderheide et al.). De plus, le débit cardiaque étant très bas pendant la RCP (environ 1 à 1,5 L/min), le rapport ventilation/perfusion est modifié : des volumes courants réduits (500-600 ml) et une fréquence basse (10/min) suffisent amplement à éliminer le CO2 produit et à oxygéner le sang.
Monitorage physiologique de l’efficacité de la RCP
Compte tenu de la complexité de ces interactions hémodynamiques, le monitorage physiologique en temps réel est recommandé pour guider la réanimation, dépassant la simple application aveugle des algorithmes.
Capnographie (EtCO2)
La mesure du CO2 expiré (EtCO2) est le reflet indirect le plus fiable du débit cardiaque généré pendant la RCP (à ventilation constante). Si les cellules produisent du CO2 mais que le débit cardiaque est nul, le CO2 ne parvient pas aux poumons et l’EtCO2 est proche de 0. Une valeur d’EtCO2 < 10 mmHg après 20 minutes de RCP est un signe de pronostic très sombre, suggérant l'impossibilité d'obtenir un ROSC. L'objectif est de maintenir une EtCO2 > 20 mmHg. Une augmentation soudaine de l’EtCO2 (souvent > 40 mmHg) est un indicateur précoce et spécifique du retour à une circulation spontanée (ROSC), souvent avant que le pouls ne soit palpable.
Pression artérielle invasive
En milieu hospitalier (salle de cathétérisme, soins intensifs), si un cathéter artériel est en place, la pression diastolique de relaxation doit être la cible principale. L’objectif est d’obtenir une pression diastolique > 25 mmHg pour assurer une pression de perfusion coronaire suffisante. L’échec à atteindre cette cible doit inciter à améliorer la qualité du massage (profondeur, relâchement), à changer de masseur, ou à administrer un vasopresseur (adrénaline) pour augmenter les résistances vasculaires systémiques.
Références
Keith G. Lurie, MD, Edward C. Nemergut, MD, Demetris Yannopoulos, MD, et Michael Sweeney, MD. La physiologie de la réanimation cardiopulmonaire. Anesthesia and Analgesia (2015).
Duggal C, Weil MH, Gazmuri RJ, Tang W, Sun S, O’Connell F, Ali M. Regional blood flow during closed-chest cardiac resuscitation in rats. J Appl Physiol 1993;74:147-52.
Matilda Jerkeman, Peter Lundgren, Elmir Omerovic, Anneli Strömsöe, Gabriel Riva, Jacob Hollenberg, Per Nivedahl, Johan Herlitz, Araz Rawshani. Association entre le type de réanimation cardiopulmonaire et la survie en cas d’arrêt cardiaque extrahospitalier : A machine learning study. Resuscitation Plus. 2022 Jun 14;10:100245.
Debaty G, Shin SD, Metzger A, Kim T, Ryu HH, Rees J, McKnite S, Matsuura T, Lick M, Yannopoulos D, Lurie K. Tilting for perfusion : head-up position during cardiopulmonary resuscitation improves brain flow in a porcine model of cardiac arrest. Resuscitation 2015;87:38-43.
Stiell IG, Brown SP, Christenson J, Cheskes S, Nichol G, Powell J, Bigham B, Morrison LJ, Larsen J, Hess E, Vaillancourt C, Davis DP, Callaway CW ; Resuscitation Outcomes Consortium (ROC) Investigators. Quel est le rôle de la profondeur de la compression thoracique pendant la réanimation d’un arrêt cardiaque extrahospitalier ? Crit Care Med 2012;40:1192-88.
Idris AH, Guffey D, Aufderheide TP, Brown S, Morrison LJ, Nichols P, Powell J, Daya M, Bigham BL, Atkins DL, Berg R, Davis D, Stiell I, Sopko G, Nichol G ; Resuscitation Outcomes Consortium (ROC) Investigators. Relation entre les taux de compression thoracique et les résultats de l’arrêt cardiaque. Circulation 2012;125:3004-12.
Sue Duval, Paul E. Pepe, MD, MPH2,3,4,5,6 ; Tom P. Aufderheide, MD, MS7 ; et al. Jeffrey M. Goodloe, MD8 ; Guillaume Debaty, MD, PhD9,10 ; José Labarère, MD, PhD9,10 ; Atsushi Sugiyama, MD, PhD11 ; Demetris Yannopoulos, MD1. Optimal Combination of Compression Rate and Depth During Cardiopulmonary Resuscitation for Functionally Favorable Survival. JAMA Cardiol. 2019;4(9):900-908. doi:10.1001/jamacardio.2019.2717
Bobrow BJ, Spaite DW, Berg RA, et al. Chest compression-only CPR by lay rescuers and survival from out-of-hospital cardiac arrest. JAMA. 2010;304(13):1447-1454.
Markstaller K, Rudolph A, Karmrodt J, et al. Effect of chest compressions only during experimental basic life support on alveolar collapse and recruitment. Resuscitation. 2008;79(1):125-132.
McDannold R, Bobrow BJ, Chikani V, Silver A, Spaite DW, Vadeboncoeur T. Quantification of ventilation volumes produced by compressions during emergency department cardiopulmonary resuscitation. Am J Emerg Med. 2018;36(9):1640-1644.
Dunham-Snary KJ, Wu D, Sykes EA, et al. Vasoconstriction pulmonaire hypoxique : des mécanismes moléculaires à la médecine. Chest. 2017;151(1):181-192.
Liste des auteurs. Leif Svensson, M.D., Ph.D., Katarina Bohm, R.N., Ph.D., Maaret Castrèn, M.D., Ph.D., Hans Pettersson, Ph.D., Lars Engerström, M.D., Johan Herlitz, M.D., Ph.D., et Mårten Rosenqvist, M.D., Ph.D. Compression-Only CPR or Standard CPR in Out-of-Hospital Cardiac Arrest. New England Journal of Medicine (2018).
Youcef Azeli, Alfredo Bardají, Eneko Barbería, Vanesa Lopez-Madrid, Jordi Bladé-Creixenti, Laura Fernández-Sender, Gil Bone, Elena Rica Susana Álvarez 11, Alberto Fernández, Christer Axelsson, Maria F Jiménez-Herrera. Clinical outcomes and safety of passive leg raising in out-of-hospital cardiac arrest : a randomized controlled trial (Résultats cliniques et sécurité de l’élévation passive des jambes en cas d’arrêt cardiaque extrahospitalier : un essai contrôlé randomisé). Critical Care (2021).
Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hypotension induite par l’hyperventilation pendant la réanimation cardiopulmonaire. Circulation 2004;109:1960-5.
Niemann JT. Differences in cerebral and myocardial perfusion during closed-chest resuscitation. Ann Emerg Med 1984;13:849-53.
Halperin HR, Tsitlik JE, Guerci AD, et al. Determinants of blood flow to vital organs during cardiopulmonary resuscitation in dogs. Circulation 1986;73:539-50.
Paradis NA, Martin GB, Rivers EP, et al. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA 1990;263:1106-13.
Cheskes S, Schmicker RH, Verbeek PR, et al. The impact of peri-shock pause on survival from out-of-hospital shockable cardiac arrest during the Resuscitation Outcomes Consortium PRIMED trial. Resuscitation 2014;85:336-42.
Steen S, Liao Q, Pierre L, et al. The critical importance of minimal delay between chest compressions and subsequent defibrillation : a haemodynamic explanation. Resuscitation 2003;58:249-58.
Berg RA, Sanders AB, Kern KB, et al. Adverse hemodynamic effects of interrupting chest compressions for rescue breathing during cardiopulmonary resuscitation for ventricular fibrillation cardiac arrest. Circulation 2001;104:2465-70.
Yannopoulos D, McKnite S, Aufderheide TP, et al. Effects of incomplete chest wall decompression during cardiopulmonary resuscitation on coronary and cerebral perfusion pressures in a porcine model of cardiac arrest. Resuscitation 2005;64:363-72.
Fried DA, Leary M, Smith DA, et al. The prevalence of chest compression leaning during in-hospital cardiopulmonary resuscitation. Resuscitation 2011;82:1019-24.