Introduction à la stimulation cardiaque et aux dispositifs : Stimulateur cardiaque, DAI, CRT
Le stimulateur cardiaque artificiel (ou pacemaker) est l’une des grandes inventions médicales du XXe siècle. La stimulation cardiaque est passée d’une expérience hasardeuse et encombrante dans les années 1930 à un traitement de routine, sûr, miniaturisé et sophistiqué, utilisé dans le monde entier. Les stimulateurs cardiaques artificiels ont énormément bénéficié des progrès de l’ingénierie, notamment avec l’avènement des transistors, des circuits programmables, des piles au lithium à longue durée de vie et des appareils connectés à Internet pour la télésurveillance. D’autres avancées majeures ont été réalisées ces dernières années, le stimulateur cardiaque sans plomb (leadless pacemaker) constituant l’évolution technologique récente la plus prometteuse pour réduire les complications liées aux sondes et aux logettes1.
Étant donné la large utilisation des stimulateurs cardiaques et la tendance à l’augmentation de l’implantation des dispositifs électroniques cardiaques implantables (CIED) en raison du vieillissement de la population, il est essentiel pour tout praticien de se familiariser avec ces dispositifs. Cette section est consacrée aux principes fondamentaux des stimulateurs cardiaques artificiels. Des dispositifs plus avancés (DCI, défibrillateur cardioverteur implantable ; TRC, thérapie de resynchronisation cardiaque) sont abordés spécifiquement dans les chapitres suivants. La première partie consiste en une révision approfondie des bases de l’automaticité cardiaque, des potentiels d’action et de la physiologie électromécanique, prérequis indispensables à la compréhension de la stimulation artificielle.
Principes de l’excitabilité myocardique et du système de conduction
Pour que la fonction de pompe cardiaque soit hémodynamiquement efficace, il est impératif que les oreillettes et les ventricules soient activés rapidement et selon une séquence temporelle précise. L’activation rapide et synchrone est cruciale pour recruter simultanément la masse myocardique maximale ; plus les fibres myocardiques se contractent en phase, plus l’éjection systolique est efficace. L’activation séquentielle implique que la systole auriculaire précède la contraction ventriculaire, optimisant ainsi le remplissage ventriculaire (contribution auriculaire au débit cardiaque) avant l’éjection. Pour coordonner ces tâches, le cœur dispose d’un stimulateur intrinsèque, le nœud sinusal, et d’un réseau de conduction électrique à haute vélocité. Ces structures spécialisées transmettent le potentiel d’action séquentiellement au myocarde contractile. La figure 1 illustre l’anatomie fonctionnelle du nœud sinusal et les composants du système de conduction.
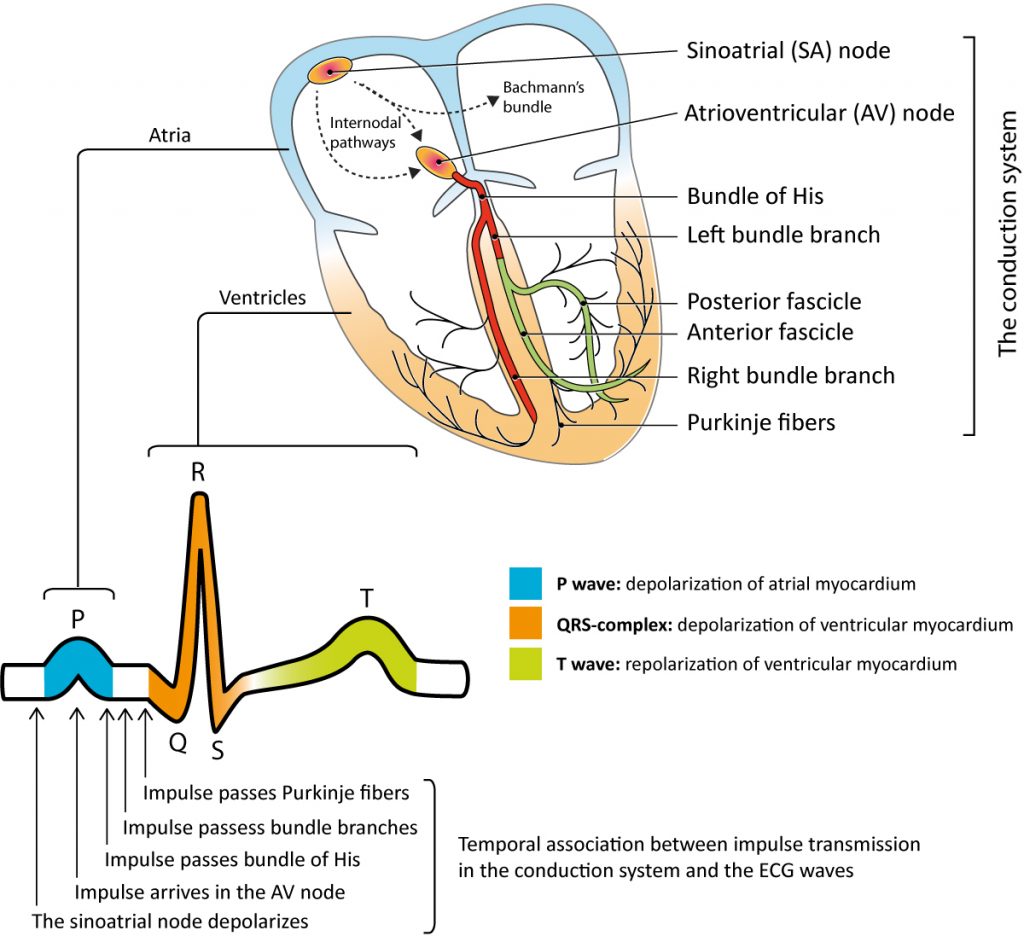
Le système de jonction auriculo-ventriculaire (AV) se compose du nœud AV, du faisceau de His et du réseau des fibres de Purkinje. Ces structures assurent la transmission de l’impulsion auriculaire vers les ventricules tout en imposant un délai physiologique (intervalle PR) nécessaire au remplissage ventriculaire. La transmission infra-hissienne est ensuite extrêmement rapide, permettant que la quasi-totalité du myocarde ventriculaire soit dépolarisée quasi simultanément. Cette activation synchrone produit un complexe QRS fin (défini par une durée <120 ms). Tout élargissement du QRS témoigne d'un asynchronisme d'activation ventriculaire, qu'il soit pathologique (bloc de branche) ou iatrogène (stimulation ventriculaire droite).
Le potentiel d’action cardiaque
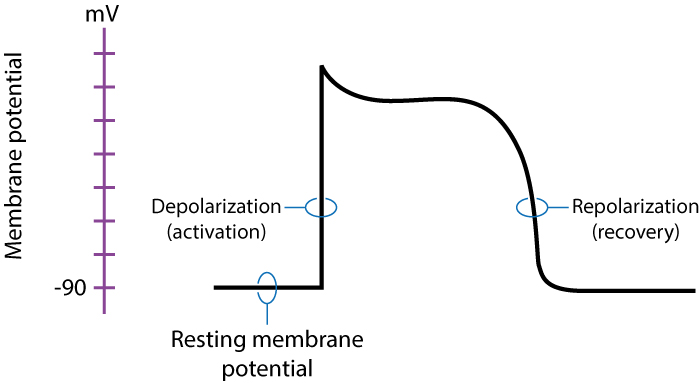
Le potentiel d’action myocardique est l’événement électrique fondamental comprenant une dépolarisation (inversion brutale de la polarité membranaire) suivie d’une repolarisation (retour à l’état de repos). Le cycle cardiaque physiologique débute lorsque le nœud sinusal génère le premier potentiel d’action, qui se propage ensuite de proche en proche. La compréhension des courants ioniques sous-jacents est essentielle pour appréhender les mécanismes de stimulation.
«
Couplage électromécanique cardiaque
La dépolarisation électrique est le déclencheur de l’activité mécanique. Elle active les canaux calciques voltage-dépendants (type L), permettant l’entrée de calcium dans le cytosol (Calcium-Induced Calcium Release), ce qui initie le glissement des myofilaments d’actine et de myosine. La propagation d’une impulsion électrique est donc directement et obligatoirement couplée à un événement mécanique ; c’est le principe du couplage électromécanique. En stimulation cardiaque, l’objectif est d’obtenir une « capture » électrique (visible sur l’ECG) qui se traduit nécessairement par une contraction mécanique (pouls).
Le système de conduction électrique du cœur
Le nœud sinusal (nœud sino-auriculaire) et l’automaticité intrinsèque
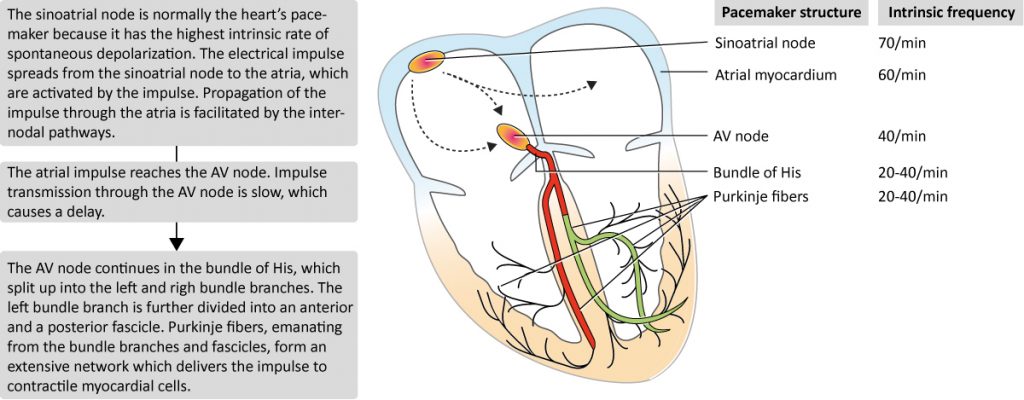
Le nœud sinusal est une structure fusiforme sous-épicardique située à la jonction de la veine cave supérieure et de l’oreillette droite haute (figure 1). Il est composé de cellules pacemaker (« P cells ») hautement spécialisées, pauvres en myofibrilles contractiles mais dotées d’une propriété unique : l’instabilité de leur potentiel de repos. Ces cellules se dépolarisent spontanément durant la diastole (phase 4 du potentiel d’action). Cette capacité est appelée automaticité. Avec une fréquence de décharge intrinsèque comprise entre 60 et 100 battements par minute au repos, le nœud sinusal impose son rythme à l’ensemble du cœur, agissant comme le stimulateur cardiaque physiologique dominant.
Stimulateurs cardiaques secondaires (latents)
En cas de défaillance du nœud sinusal, des structures hiérarchiquement inférieures peuvent prendre le relais. Ces pacemakers « latents » ou subsidiaires possèdent également l’automatisme, mais à une fréquence intrinsèque plus lente :
- Tissu auriculaire spécialisé : Certains foyers situés près de la crista terminalis, de l’ostium du sinus coronaire et autour des anneaux valvulaires possèdent des propriétés d’automaticité.
- La jonction AV : Le nœud AV lui-même (sa zone compacte) ne possède probablement pas d’automatisme propre significatif. Cependant, la zone de jonction nodo-hissienne et le faisceau de His proximal sont capables de générer un rythme d’échappement jonctionnel (environ 40-60 bpm).
- Le réseau de His-Purkinje : Le système de Purkinje ventriculaire possède un automatisme lent (20-40 bpm). Ces rythmes idioventriculaires sont souvent instables et hémodynamiquement précaires.
Le cœur fonctionne donc selon une hiérarchie de suppression (overdrive suppression) : le stimulateur le plus rapide (normalement le nœud sinusal) dépolarise et réinitialise constamment les foyers plus lents avant qu’ils n’atteignent leur seuil de décharge. La défaillance du pacemaker dominant permet l’émergence (l’échappement) d’un pacemaker subsidiaire.
Stimulateurs cardiaques artificiels : Indications et conséquences
L’incapacité du nœud sinusal à générer des impulsions (incompétence chronotrope, pauses sinusales) ou l’incapacité du système de conduction à transmettre ces impulsions vers les ventricules entraîne une bradycardie pathologique. Si les mécanismes de compensation (pacemakers latents) préviennent l’asystolie immédiate par des rythmes d’échappement, cette situation n’est pas viable physiologiquement :
- Insuffisance débitmétrique : Les rythmes d’échappement sont lents. Le débit cardiaque étant le produit de la fréquence cardiaque par le volume d’éjection systolique ($DC = FC \times VES$), une fréquence trop basse ne peut être compensée indéfiniment par l’augmentation du VES.
- Instabilité électrique : Les rythmes d’échappement, particulièrement idioventriculaires, sont peu fiables (« unreliable ») et peuvent s’arrêter inopinément, conduisant à la syncope d’Adams-Stokes ou à la mort subite.
- Désynchronisation : En cas de bloc AV complet, la dissociation entre oreillettes et ventricules entraîne la perte de la contribution auriculaire au remplissage, aggravant l’insuffisance cardiaque.
Les stimulateurs cardiaques artificiels sont indiqués formellement lorsque ces défauts de formation ou de conduction provoquent une bradycardie symptomatique ou menaçant le pronostic vital. Les deux grandes classes d’indications sont le dysfonctionnement sinusal (maladie de l’oreillette) et les blocs auriculo-ventriculaires de haut degré.
La symptomatologie clinique est directement corrélée à la baisse du débit cardiaque et à l’hypoperfusion cérébrale : vertiges, lipothymies, syncopes à l’emporte-pièce. Dans les formes chroniques moins sévères, on observe une dyspnée d’effort, une asthénie, une incompétence chronotrope (incapacité à accélérer la fréquence cardiaque à l’effort) ou une décompensation d’insuffisance cardiaque.
Composants d’un système de stimulation
Un système de stimulation conventionnel comprend trois éléments principaux qui forment un circuit électrique fermé :
- Le générateur d’impulsions (le boîtier) : Il contient la source d’énergie (batterie au lithium-iode) et les circuits électroniques (microprocesseur) qui contrôlent la logique de stimulation et de détection. Le boîtier métallique agit généralement comme l’anode (pôle positif) en stimulation unipolaire.
- Les sondes (électrodes) : Ce sont des fils conducteurs isolés qui relient le générateur au myocarde. Elles transmettent l’impulsion électrique vers le cœur (stimulation) et renvoient les signaux électriques cardiaques vers le générateur (détection). Les sondes peuvent être fixées au myocarde par des mécanismes passifs (barbes) ou actifs (vis hélicoïdale).
- Le tissu myocardique (la charge) : L’interface entre l’électrode et le myocarde est le siège de la stimulation.
Les systèmes modernes peuvent être monochambre (une sonde dans l’OD ou le VD), bicambre (sondes dans l’OD et le VD pour maintenir la synchronisation AV) ou tricambre (biventriculaire pour la resynchronisation).
Physiologie cellulaire : Le potentiel pacemaker
Pour comprendre comment une impulsion artificielle peut capturer le cœur, il faut examiner les mécanismes ioniques. L’automaticité des cellules du nœud sinusal résulte d’une dépolarisation diastolique lente (phase 4). Contrairement aux cellules contractiles, ces cellules n’ont pas de potentiel de repos stable. Dès la fin de la repolarisation, des canaux spécifiques s’activent (figure 4) :
- Le courant « funny » ($I_f$) : C’est un courant entrant mixte de sodium (Na+) et de potassium (K+), activé par l’hyperpolarisation. Il est le principal responsable de la pente de dépolarisation diastolique spontanée.
- Les courants calciques ($I_{Ca-T}$ et $I_{Ca-L}$) : Lorsque le potentiel membranaire atteint environ -55 mV à -40 mV, les canaux calciques s’ouvrent, prenant le relais pour atteindre le seuil de déclenchement du potentiel d’action.
Une fois le seuil atteint, la phase 0 (dépolarisation rapide) dans le nœud sinusal est dépendante du calcium, ce qui la rend plus lente que la dépolarisation sodique des cellules ventriculaires. La repolarisation (phase 3) est assurée par l’ouverture des canaux potassiques (K+).
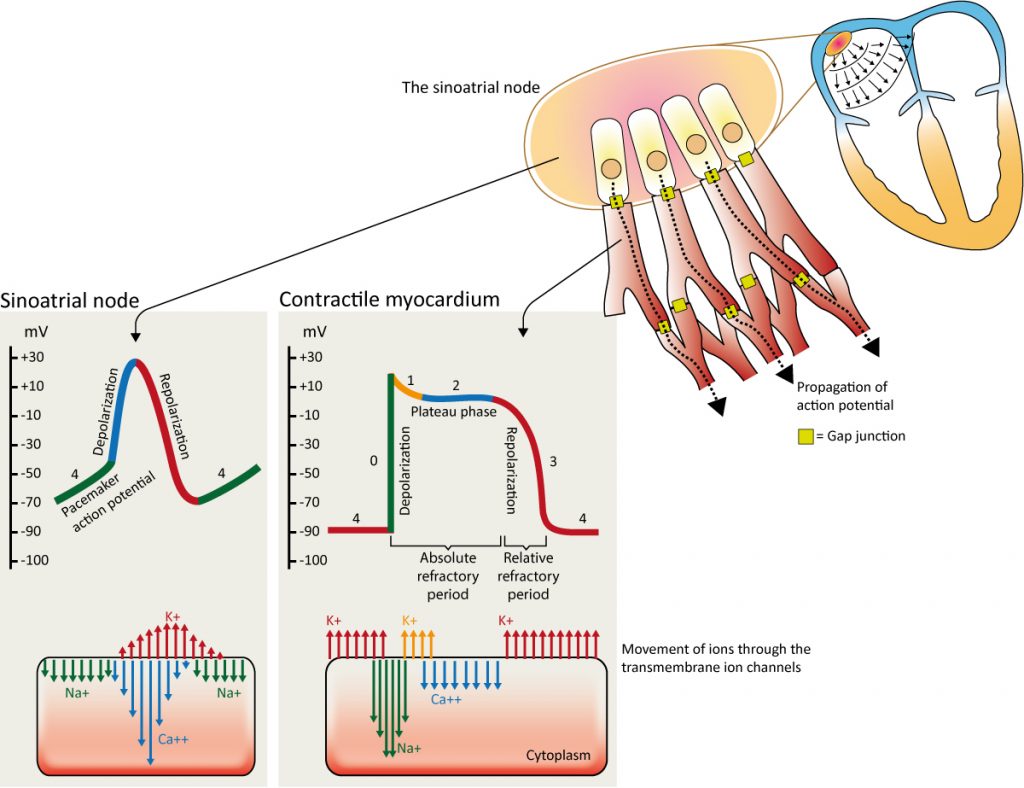
La propagation du potentiel d’action est assurée par les jonctions communicantes (gap junctions) qui connectent électriquement les cellules cardiaques, formant un syncytium fonctionnel. La densité de ces connexines détermine la vitesse de conduction : très élevée dans le réseau de Purkinje (conduction rapide), très faible dans le nœud AV (conduction décrémentielle pour protéger le ventricule).
Les cellules contractiles ventriculaires, cibles habituelles de la stimulation, ont un potentiel de repos stable très négatif (-90 mV). Elles nécessitent un stimulus externe (physiologique ou artificiel) pour ouvrir les canaux sodiques rapides (Na+) et déclencher la cascade d’activation.
Pour en savoir plus : Électrophysiologie cardiaque : potentiel d’action, automaticité et vecteurs
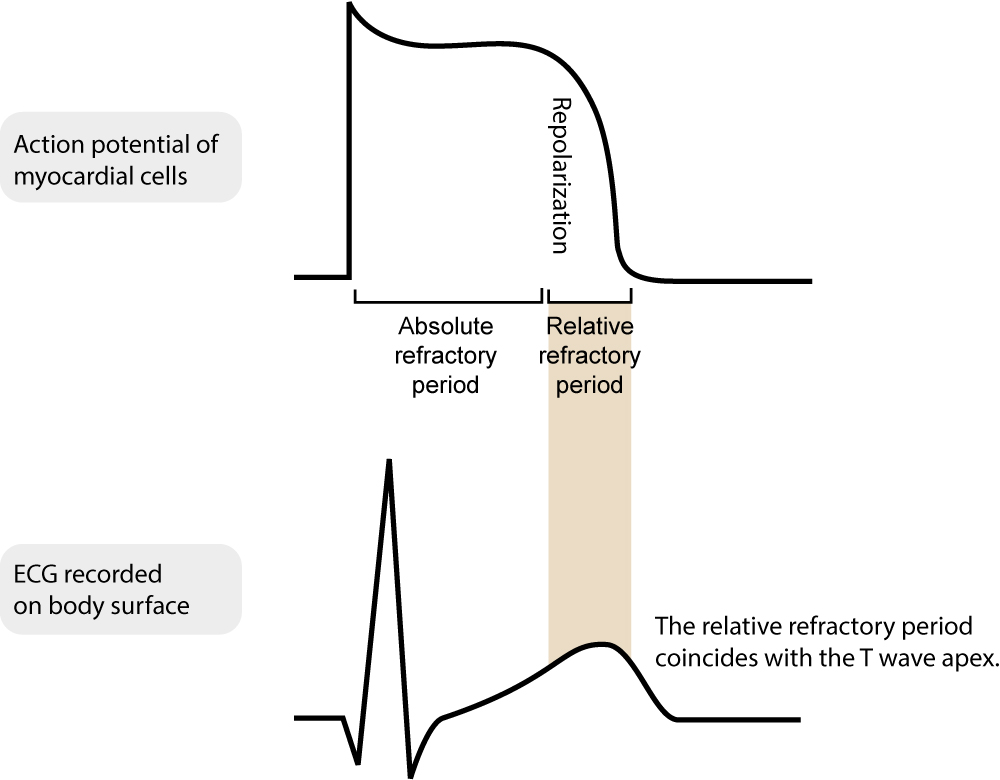
Périodes réfractaires absolue et relative
La notion de période réfractaire est fondamentale en rythmologie, tant pour la physiologie que pour la programmation des pacemakers. Pendant la majeure partie du potentiel d’action, la cellule myocardique est en période réfractaire absolue (PRA) : aucun stimulus, quelle que soit son intensité (y compris un spike de pacemaker), ne peut déclencher un nouveau potentiel d’action car les canaux sodiques sont inactivés.
Elle est suivie d’une période réfractaire relative (PRR), coïncidant avec la fin de la repolarisation (onde T). Durant cette phase, un stimulus supraliminaire peut déclencher un potentiel d’action, mais celui-ci sera propagé plus lentement. C’est la « période vulnérable » où une stimulation inappropriée (phénomène R-sur-T) peut induire une fibrillation ventriculaire.
Principes de fonctionnement des stimulateurs modernes
Les stimulateurs cardiaques modernes ne se contentent pas de délivrer des impulsions à une fréquence fixe. Ils interagissent dynamiquement avec le rythme intrinsèque du patient. Deux concepts sont fondamentaux :
1. Stimulation (Pacing) et Capture
La fonction première est de délivrer une impulsion électrique brève (environ 0,4 à 1,0 ms) mais d’intensité suffisante pour dépolariser le myocarde local. L’énergie minimale requise pour obtenir une capture myocardique constante est appelée le seuil de stimulation. Pour la sécurité du patient, le stimulateur est programmé avec une marge de sécurité (généralement 2 fois le seuil de tension).
2. Détection (Sensing)
Le stimulateur « écoute » l’activité électrique spontanée du cœur via les mêmes sondes. Si une dépolarisation intrinsèque (onde P ou complexe QRS) est détectée, le stimulateur inhibe son impulsion pour éviter une compétition avec le rythme propre du patient. C’est le mode « à la demande » (demand pacing). La qualité du signal perçu (amplitude de l’onde R ou P) est cruciale pour le bon fonctionnement de l’appareil.
Le Code NBG (Nomenclature)
Pour décrire le mode de fonctionnement d’un stimulateur, une nomenclature internationale à 5 lettres (Code NBG) est utilisée. Les trois premières positions sont les plus utilisées en clinique courante :
- Position I : La chambre stimulée (A = Atrium, V = Ventricule, D = Double).
- Position II : La chambre détectée (A = Atrium, V = Ventricule, D = Double).
- Position III : La réponse à la détection (I = Inhibé, T = Déclenché, D = Double).
Par exemple, un mode VVI signifie que le ventricule est stimulé, le ventricule est écouté, et si un QRS spontané est détecté, la stimulation est inhibée. Un mode DDD permet une stimulation et une détection dans les deux chambres, assurant une synchronisation auriculo-ventriculaire optimale.
Les stimulateurs cardiaques modernes peuvent également adapter leur fréquence à l’effort (asservissement ou réponse en fréquence, indiqué par la lettre R en 4ème position, ex: DDDR) grâce à des capteurs d’activité physique ou de ventilation minute. Ils intègrent aussi des algorithmes complexes pour minimiser la stimulation ventriculaire inutile et gérer les épisodes d’arythmies auriculaires (mode « switch »).
Références bibliographiques
Reynolds et al. A Leadless Intracardiac Transcatheter Pacing System. The New England Journal of Medicine.
Mulpuru et al. Cardiac Pacemakers: Function, Troubleshooting, and Management. JACC.
Brignole M et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal.