L’embolie pulmonaire (EP) survient lorsque des thrombus veineux, ou d’autres matières emboliques, s’embolisent dans l’artère pulmonaire ou ses branches. Dans la majorité des cas, le thrombus se forme dans les veines profondes des jambes ou du bassin (thrombose veineuse profonde, TVP). Les thrombus formés dans ce réseau veineux profond peuvent se détacher et migrer via la veine cave inférieure vers l’oreillette droite et le ventricule droit. Le thrombus est ensuite propulsé du ventricule droit à travers la valve pulmonaire dans l’artère pulmonaire principale. En fonction de la taille, de la forme et du nombre de thrombus, ceux-ci obstruent l’artère pulmonaire principale ou ses branches lobaires, segmentaires ou sous-segmentaires. Plus le thrombus est volumineux et central, plus l’occlusion est proximale et, par conséquent, plus les répercussions hémodynamiques sont sévères.
L’occlusion artérielle pulmonaire engendre deux conséquences physiopathologiques immédiates :
- Une augmentation de l’espace mort alvéolaire et une inadéquation ventilation-perfusion (effet shunt), entraînant une hypoxie et une hypocapnie.
- Une augmentation brutale de la postcharge du ventricule droit, menant à une réduction de la précharge du ventricule gauche et, in fine, une réduction du débit cardiaque.
Une réduction substantielle de la perfusion pulmonaire et la réduction subséquente de la précharge du ventricule gauche entraînent une cascade d’altérations hémodynamiques (choc obstructif) qui peuvent aboutir à un arrêt cardiaque par dissociation électromécanique.
L’embolie pulmonaire et la thrombose veineuse profonde (TVP) constituent les deux facettes d’une même entité clinique : la maladie thromboembolique veineuse (MTEV). Environ 70 % des patients présentant une embolie pulmonaire symptomatique ont une TVP concomitante (souvent asymptomatique), et jusqu’à 50 % des patients présentant une TVP proximale ont des embolies pulmonaires asymptomatiques (Di Nisio et al). En conséquence, les facteurs de risque d’embolie pulmonaire se recoupent avec ceux de la TVP ; l’immobilisation, la chirurgie majeure, l’hypercoagulabilité (néoplasie, thrombophilie) et la grossesse sont des facteurs prédisposants majeurs (voir Facteurs de risque ci-dessous).
La prise en charge thérapeutique dépend de la stratification du risque. Une proportion significative des cas d’embolie pulmonaire à haut risque nécessite une stratégie de reperfusion (thrombolyse systémique, embolectomie chirurgicale ou traitements par cathéter) pour lever l’obstruction. L’administration de la thrombolyse nécessite un examen rigoureux des contre-indications absolues et relatives et l’exclusion formelle des diagnostics différentiels critiques ; la tamponnade cardiaque, l’anévrisme aortique et la dissection aortique aiguë sont des diagnostics différentiels dont le tableau clinique peut mimer une EP massive mais pour lesquels la thrombolyse serait fatale.
La thromboembolie veineuse est une maladie chronique et grave comportant un risque de récidive. La mortalité liée à l’embolie pulmonaire non traitée est élevée, mais chute drastiquement sous traitement adéquat. Environ 30 % des patients souffrant d’une embolie pulmonaire ou d’une thrombose veineuse profonde subissent un second événement thrombotique dans les 10 ans, soulignant l’importance de la durée de l’anticoagulation (Goldhaber et al, Kearon et al).
Épidémiologie de l’embolie pulmonaire
- La thromboembolie veineuse (TEV) est la troisième cause de mortalité cardiovasculaire dans le monde, après l’accident vasculaire cérébral et l’infarctus aigu du myocarde. On estime que 10 millions de cas de thromboembolie veineuse surviennent chaque année dans le monde (Raskob et al.).
- L’incidence de l’embolie pulmonaire a augmenté au cours des dernières décennies. Cette tendance s’explique par le vieillissement de la population, l’augmentation de la prévalence du cancer, de l’insuffisance cardiaque, de l’obésité et des comorbidités chroniques. Parallèlement, l’utilisation accrue de l’angioscanner pulmonaire (CTPA) a permis de détecter des embolies pulmonaires plus distales (sous-segmentaires), dont la signification clinique est parfois débattue.
- L’embolie pulmonaire reste une cause majeure de mortalité hospitalière évitable. Le risque de développer une thromboembolie veineuse au cours de la vie est estimé à 8 % pour les personnes âgées de 45 ans (Raskob et al., Heit et al.).
Effets cardio-pulmonaires de l’embolie pulmonaire
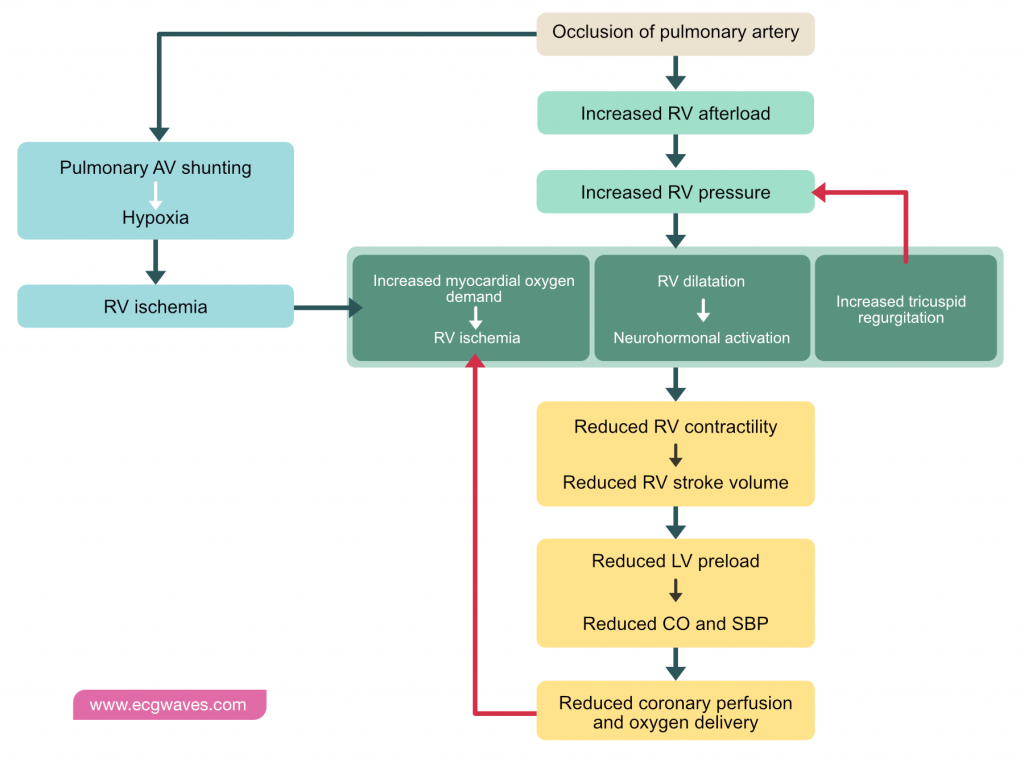
Effets hémodynamiques et dysfonction ventriculaire droite
L’embolie pulmonaire entraîne une augmentation brutale de la résistance vasculaire pulmonaire (RVP), et donc une augmentation de la postcharge imposée au ventricule droit (VD). Contrairement au ventricule gauche, le VD est une chambre à paroi fine, adaptée aux volumes mais peu tolérante aux augmentations aiguës de pression. L’augmentation de la postcharge entraîne une augmentation de la tension pariétale du VD, augmentant sa consommation en oxygène.
Pour maintenir le débit, le VD se dilate (mécanisme de Frank-Starling) et son temps de contraction s’allonge. Cette dilatation entraîne une déformation du septum interventriculaire qui bombe vers la gauche (septum paradoxal), gênant le remplissage du ventricule gauche (interdépendance ventriculaire).
L’embolie pulmonaire entraîne une augmentation de la postcharge du ventricule droit, une dilatation du VD, une insuffisance tricuspidienne fonctionnelle et une augmentation de la demande en oxygène myocardique.
Malgré la dilatation, une ischémie myocardique du VD se développe car la demande en oxygène dépasse l’apport. L’hypotension systémique et l’augmentation de la pression intramurale du VD réduisent le gradient de perfusion coronarien droit. Une ischémie prolongée conduit à une hypokinésie et potentiellement à un infarctus du ventricule droit. Ce cercle vicieux — dilatation, ischémie, baisse de la contractilité — entraîne une réduction du volume systolique du ventricule droit. Par conséquent, moins de sang parvient au ventricule gauche, diminuant sa précharge. La diminution de la précharge gauche entraîne une baisse du débit cardiaque systémique et une hypotension artérielle.
La chute progressive du débit cardiaque, de la pression artérielle systolique et de la perfusion coronarienne aboutit finalement à un choc cardiogénique obstructif et à l’arrêt cardiaque, généralement par activité électrique sans pouls (AESP).
La défaillance ventriculaire droite aiguë est également décrite comme cœur pulmonaire aigu ou dysfonction VD.
Effets pulmonaires et échanges gazeux
L’obstruction des artères pulmonaires entraîne une augmentation de l’espace mort physiologique (zones ventilées mais non perfusées). De plus, la redistribution du flux sanguin vers les zones non obstruées peut créer un effet shunt (zones perfusées mais mal ventilées). Cela conduit à une hypoxémie artérielle (baisse de la PaO2).
L’irritation des récepteurs pulmonaires provoque une hyperventilation réflexe, entraînant souvent une hypocapnie (baisse de la PaCO2) et une alcalose respiratoire.
Une hypoxie tissulaire prolongée dans les zones distales non perfusées peut entraîner un infarctus pulmonaire, surtout si la circulation bronchique collatérale est insuffisante. Celui-ci se manifeste par une douleur thoracique pleurétique (respiro-dépendante) et parfois un épanchement pleural exsudatif. L’infarctus pulmonaire entraîne une hémorragie alvéolaire qui se manifeste cliniquement par une hémoptysie.
Symptômes et signes de l’embolie pulmonaire
Le spectre clinique de l’EP est extrêmement large, allant du patient asymptomatique (découverte fortuite) au collapsus cardiovasculaire brutal. Dans la majorité des cas symptomatiques, le début est aigu. L’apparition des symptômes peut être déclenchée par un lever ou une activité physique (mobilisation du caillot).
Les symptômes dépendent des effets hémodynamiques de l’occlusion et de la réserve cardio-respiratoire du patient. Les petites embolies distales peuvent ne provoquer qu’une douleur pleurale, tandis que les embolies proximales massives entraînent une défaillance cardiaque droite aiguë.
Les symptômes et les signes les plus courants sont les suivants (étude PIOPED II) :
- Dyspnée (essoufflement) soudaine et inexpliquée (présente chez ~73 % des patients).
- Douleur thoracique de type pleural (aggravée par l’inspiration) (~66 %).
- Toux (~37 %).
- Hémoptysie (~13 %).
- Tachypnée (fréquence respiratoire > 20/min).
- Tachycardie (FC > 100 bpm).
- Signes de thrombose veineuse profonde (TVP) : douleur au mollet, œdème, chaleur, signe de Homans (inconstant).
- Turgescence jugulaire (signe d’insuffisance ventriculaire droite).
- Hypotension artérielle et signes de choc (marbrures, extrémités froides).
- Syncope ou pré-syncope (perte de connaissance initiale), signe de gravité majeur indiquant une réduction critique du débit cérébral.
- Fièvre (généralement modérée).
L’hypotension, la chute de la pression artérielle systolique, la syncope ou l’arrêt cardiaque inaugural sont des marqueurs d’instabilité hémodynamique définissant l’EP à haut risque.
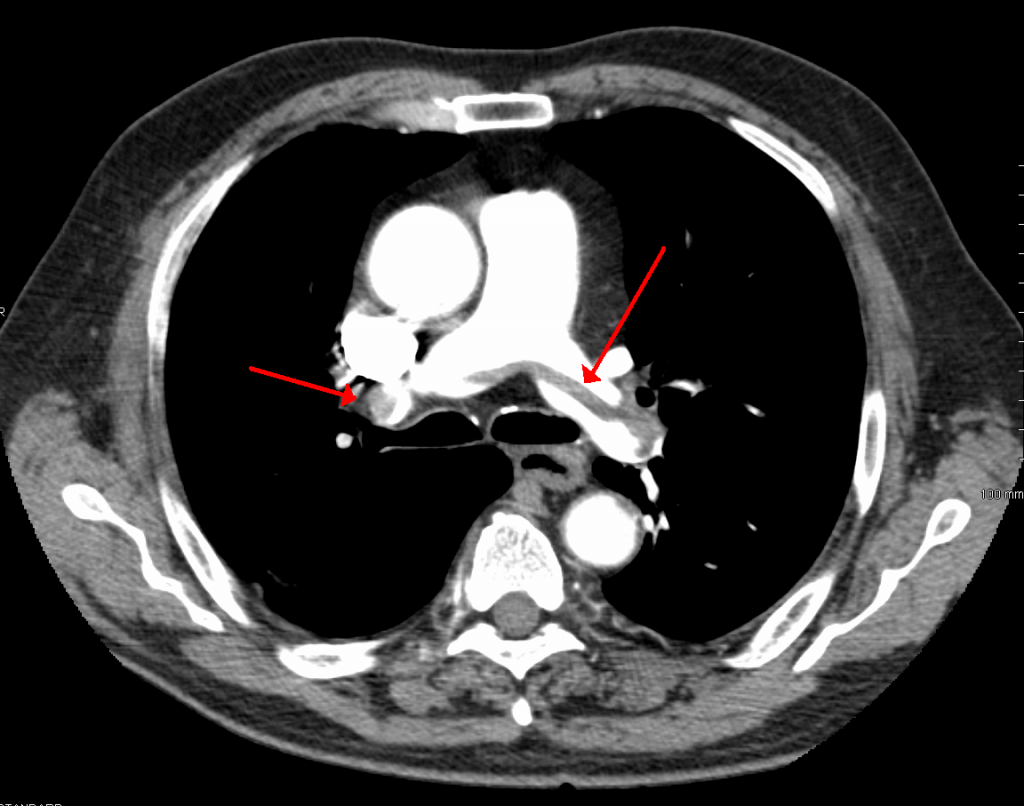
Embolie pulmonaire en selle
L’embolie pulmonaire « en selle » correspond à un thrombus volumineux qui chevauche la bifurcation du tronc de l’artère pulmonaire, s’étendant simultanément vers les artères pulmonaires droite et gauche. L’image tomodensitométrique évoque une selle de cheval (figure 2). Bien que radiologiquement impressionnante, la gravité hémodynamique dépend du degré d’obstruction (le flux peut persister autour du caillot). Cependant, ces emboles présentent un risque élevé de rupture et d’occlusion distale massive, ou d’instabilité hémodynamique soudaine.
Causes et étiologies
Si la thrombose veineuse est la cause prédominante, d’autres matériels peuvent obstruer l’arbre artériel pulmonaire :
- La thrombose veineuse profonde (TVP) : cause la plus fréquente (>90 %).
- L’embolie graisseuse : survient typiquement 12 à 72h après une fracture des os longs (fémur, tibia) ou un polytraumatisme.
- L’embolie de ciment : migration de polyméthacrylate de méthyle (PMMA) lors de vertébroplasties percutanées.
- Embolie aérienne : complication iatrogène (cathéters centraux, chirurgie) ou traumatique (barotraumatisme).
- Embolie de liquide amniotique : complication obstétricale rare mais gravissime.
- Embolie septique : endocardite du cœur droit (souvent liée à l’usage de drogues intraveineuses) ou thrombophlébite suppurée (syndrome de Lemierre).
- Embolie tumorale : obstruction par des amas cellulaires néoplasiques (cancer du rein, hépatocarcinome).
Facteurs de risque de la maladie thromboembolique veineuse
Les facteurs de risque sont classés en majeurs (forts), intermédiaires et mineurs (faibles), selon la triade de Virchow (stase veineuse, lésion endothéliale, hypercoagulabilité).
Hypercoagulabilité et facteurs biologiques
- Âge avancé (risque doublé par décennie après 40 ans)
- Cancer actif (risque fort, surtout pancréas, poumon, cerveau, hémopathies)
- Syndrome des antiphospholipides
- Traitement hormonal (contraceptifs oraux combinés, traitement substitutif de la ménopause)
- Grossesse et post-partum (risque accru jusqu’à 6-12 semaines après l’accouchement)
- Obésité (IMC > 30 kg/m²)
- Maladies inflammatoires chroniques de l’intestin (Crohn, RCH)
- Syndrome néphrotique
Interventions, traumatismes et immobilisation
- Chirurgie majeure (orthopédique, abdominale, pelvienne) sous anesthésie générale
- Traumatismes majeurs et fractures des membres inférieurs
- Lésion de la moelle épinière
- Implantation de dispositifs (cathéter veineux central, stimulateur cardiaque)
- Hospitalisation pour maladie aiguë (insuffisance cardiaque, insuffisance respiratoire)
- Immobilisation prolongée (alitement > 3 jours) ou voyages longs (> 4 heures)
Thrombophilies héréditaires
- Mutation du facteur V de Leiden (résistance à la protéine C activée) – la plus fréquente
- Mutation du gène de la prothrombine (G20210A)
- Déficit en antithrombine, protéine C ou protéine S (plus rares mais risque thrombotique élevé)
Une enquête étiologique (bilan de thrombophilie) doit être envisagée si le patient est jeune (< 50 ans), en cas d'épisode idiopathique (non provoqué), s’il y a une histoire familiale au premier degré ou en cas de récidives.
Diagnostic et Pronostic de l’embolie pulmonaire
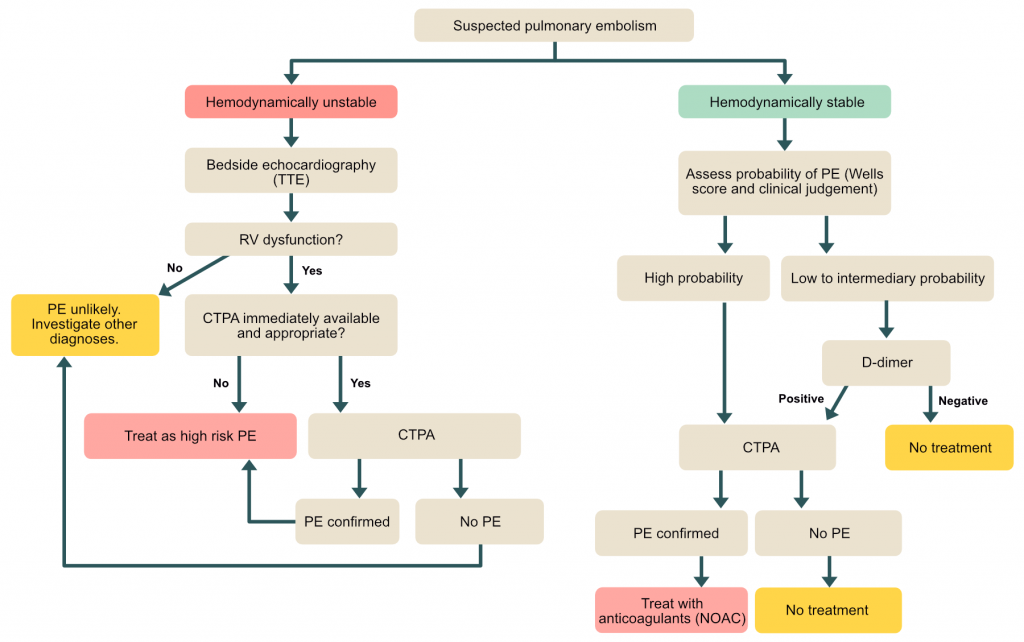
Probabilité clinique pré-test
Chez le patient hémodynamiquement stable, la démarche diagnostique repose sur l’évaluation de la probabilité clinique pré-test. Cela permet d’éviter les examens irradiants inutiles chez les patients à faible risque. Si la probabilité est élevée, l’imagerie est indiquée d’emblée.
Les scores validés sont :
- Score de Wells (version originale ou simplifiée).
- Score de Genève révisé (version originale ou simplifiée).
- PERC (Pulmonary Embolism Rule-out Criteria) : utilisé uniquement pour exclure l’EP chez les patients à probabilité clinique faible.
Important : Chez le patient en état de choc ou hypotendu (instable), l’algorithme diffère. Une échocardiographie au lit du patient (POCUS) est souvent l’examen de première intention pour rechercher des signes de cœur pulmonaire aigu avant un éventuel scanner si le patient est transportable.
Score de Wells pour l’embolie pulmonaire
Tableau 1. Critères de Wells pour l’embolie pulmonaire
| CRITÈRES | POINTS |
|---|---|
| Symptômes ou signes cliniques de TVP | 3 |
| Diagnostic alternatif moins probable que l’EP | 3 |
| Antécédent de MTEV (EP ou TVP) | 1,5 |
| Tachycardie (FC >100/bpm) | 1,5 |
| Immobilisation ou chirurgie (< 4 semaines) | 1,5 |
| Hémoptysie | 1 |
| Cancer (traitement en cours ou < 6 mois) | 1 |
Interprétation du score de Wells
Score de Wells (système à 2 niveaux – recommandé)
- ≤ 4 points : EP improbable. Doser les D-dimères.
- > 4 points : EP probable. Réaliser un angioscanner directement.
Score de Genève révisé
Tableau 2. Score de Genève révisé (version originale)
| CRITÈRE | POINTS |
|---|---|
| Âge > 65 ans | 1 |
| Antécédent de MTEV (EP ou TVP) | 3 |
| Chirurgie ou fracture (< 1 mois) | 2 |
| Cancer actif | 2 |
| Douleur unilatérale au membre inférieur | 3 |
| Hémoptysie | 2 |
| Fréquence cardiaque 75-94 bpm | 3 |
| Fréquence cardiaque ≥ 95/min | 5 |
| Douleur à la palpation du trajet veineux et œdème unilatéral | 4 |
Critères d’exclusion de l’embolie pulmonaire (PERC)
Si la probabilité clinique est faible, le PERC permet d’éviter le dosage des D-dimères. Si tous les 8 critères sont absents (score = 0), le risque d’EP est < 2% et aucune investigation supplémentaire n'est requise.
Tableau 3. Critères PERC
| CRITÈRES (Doivent tous être négatifs pour exclure l’EP) | POINTS |
|---|---|
| Âge ≥ 50 ans | 1 |
| Fréquence cardiaque ≥ 100/min | 1 |
| Saturation en oxygène (SaO2) < 95 % | 1 |
| Hémoptysie | 1 |
| Prise d’oestrogènes exogènes | 1 |
| Antécédent de TEV (EP ou TVP) | 1 |
| Chirurgie ou traumatisme récent (< 4 semaines) | 1 |
| Œdème unilatéral des membres inférieurs | 1 |
Biomarqueurs : D-dimères et Troponine
Les D-dimères sont des produits de dégradation de la fibrine. Leur valeur prédictive négative est excellente.
Seuil ajusté à l’âge : Chez les patients > 50 ans, le seuil de positivité des D-dimères doit être ajusté : Âge x 10 µg/L. (Exemple : 80 ans = seuil de 800 µg/L). Cela améliore la spécificité sans réduire la sensibilité.
Des D-dimères négatifs excluent l’embolie pulmonaire chez les patients à probabilité clinique faible ou intermédiaire. Ils ne doivent pas être utilisés si la probabilité clinique est forte (risque de faux négatif).
Biomarqueurs pronostiques
- La troponine (I ou T) : son élévation reflète une souffrance myocardique ventriculaire droite. C’est un marqueur de gravité (risque intermédiaire-élevé ou élevé) et de mortalité à court terme.
- Le BNP ou NT-proBNP : marqueurs de distension ventriculaire droite. Leur élévation a une valeur pronostique péjorative similaire à la troponine.
- Le lactate artériel : une élévation signe une hypoperfusion tissulaire et un choc imminent.
L’ECG dans l’embolie pulmonaire
L’ECG est souvent anormal mais non spécifique. Son intérêt principal est d’éliminer un IDM ou une péricardite.
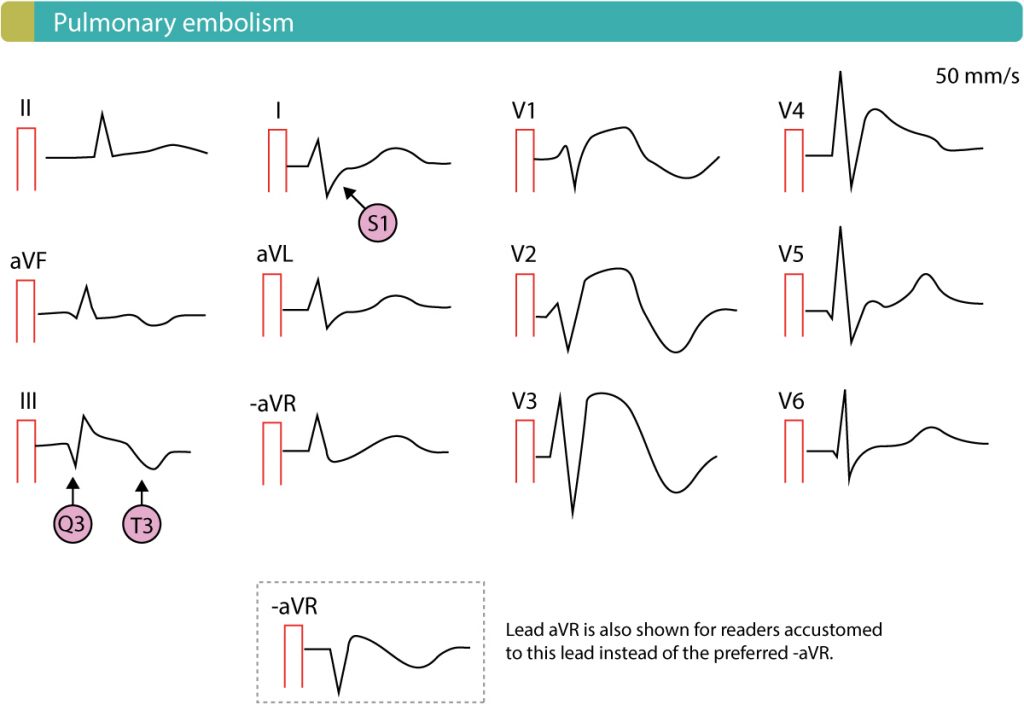
Signes ECG évocateurs de surcharge ventriculaire droite (cœur pulmonaire aigu) :
- Tachycardie sinusale : signe le plus fréquent (sensible mais peu spécifique).
- Aspect S1Q3T3 (classique mais rare) : onde S en DI, onde Q et onde T négative en DIII.
- Ondes T négatives en précordial droit (V1-V4) : signe de surcharge VD, corrélé à la dysfonction VD sévère.
- Bloc de branche droit (BBD) complet ou incomplet d’apparition récente.
- Fibrillation auriculaire d’apparition récente.
- Déviation axiale droite.
- Onde P pulmonaire (haute et pointue en DII).
Imagerie diagnostique
Angioscanner des artères pulmonaires (CTPA)
L’angioscanner thoracique est l’examen de référence (Gold Standard). Il permet de visualiser le thrombus sous forme de lacune endoluminale. Il offre l’avantage de visualiser le parenchyme pulmonaire (diagnostic différentiel, pneumonie, tumeur) et d’évaluer le rapport VD/VG (signe de gravité si > 1 ou > 0.9).
Contre-indications : Allergie sévère au produit de contraste, insuffisance rénale sévère (bien que le risque vital de l’EP prime souvent), grossesse (balance bénéfice/risque à évaluer, mais reste possible avec précautions).
Scintigraphie pulmonaire (Ventilation/Perfusion)
Alternative de choix en cas d’insuffisance rénale, d’allergie aux produits de contraste ou chez la femme enceinte (faible irradiation foetale). Le diagnostic repose sur la mise en évidence d’un défect de perfusion dans un territoire normalement ventilé (mismatch).
Échocardiographie Transthoracique (ETT)
L’échocardiographie est cruciale chez le patient instable pour le diagnostic différentiel (tamponnade, dysfonction VG) et la recherche de signes de cœur pulmonaire. Chez le patient stable, elle participe à la stratification du risque.
Signes échocardiographiques de dysfonction VD :
- Dilatation du VD : Rapport diamètre VD/VG > 1.0 (coupe apicale 4 cavités).
- Signe de McConnell : Akinésie de la paroi libre du VD avec préservation de la contractilité de l’apex (spécifique de l’EP aiguë).
- Signe du « D » septal : Aplatissement du septum interventriculaire en systole (surcharge en pression) ou diastole (surcharge en volume).
- Signe « 60/60 » : Temps d’accélération pulmonaire < 60 ms avec un gradient tricuspide < 60 mmHg.
- Augmentation de la régurgitation tricuspide (Vmax > 2.8 m/s).
- Dilatation de la veine cave inférieure sans collapsus inspiratoire.
- Thrombus mobile dans les cavités droites (thrombus en transit) : urgence absolue.
Échographie veineuse des membres inférieurs
La mise en évidence d’une TVP proximale chez un patient suspect d’EP évite parfois le recours au scanner si celui-ci est contre-indiqué, et justifie l’anticoagulation.
Traitement de l’embolie pulmonaire
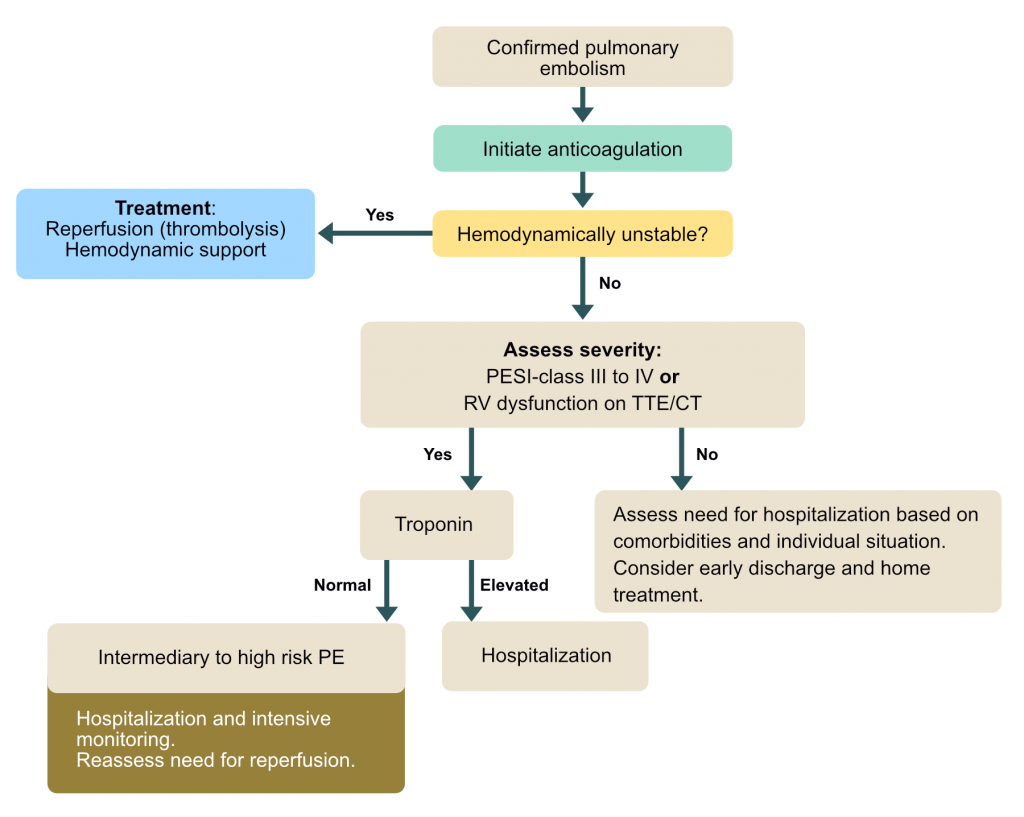
Le traitement dépend de la stratification du risque (recommandations ESC) :
- Haut risque (anciennement « Massive ») : Choc ou hypotension persistante. Urgence vitale, nécessite une reperfusion.
- Risque intermédiaire (Intermédiaire-Haut ou Intermédiaire-Bas) : Patient normotendu mais avec signes de dysfonction VD (Echo/CT) et/ou élévation de la troponine.
- Faible risque : Patient stable sans dysfonction VD ni biomarqueurs élevés. Candidat potentiel à une sortie précoce.
Stratification du risque : Score PESI
Le PESI (Pulmonary Embolism Severity Index) ou sa version simplifiée (sPESI) est utilisé pour identifier les patients à faible risque pouvant être traités en ambulatoire.
Tableau 4. Score PESI original
| CRITÈRES | POINTS |
|---|---|
| Âge | Âge (en années) |
| Sexe masculin | 10 |
| Cancer | 30 |
| Insuffisance cardiaque chronique | 10 |
| Maladie pulmonaire chronique | 10 |
| Fréquence cardiaque ≥ 110/min | 20 |
| Tension artérielle systolique < 100 mm Hg | 30 |
| Fréquence respiratoire ≥ 30/min | 20 |
| Température < 36°C | 20 |
| Altération de l’état mental | 60 |
| Saturation en oxygène < 90% | 20 |
Classification du risque selon le PESI
- Classes I-II (≤ 85 points) : Risque faible (Mortalité < 3.5%). Candidat aux soins ambulatoires.
- Classes III-V (> 85 points) : Risque intermédiaire à élevé. Hospitalisation requise.
Traitement de l’embolie pulmonaire à haut risque (instable)
Les patients présentant un choc obstructif ou une hypotension persistante (PAS < 90 mmHg ou chute de > 40 mmHg) ont un risque de décès intra-hospitalier élevé. La priorité est le rétablissement de la perfusion pulmonaire.
Mesures de réanimation immédiates :
- Oxygénothérapie (objectif SaO2 > 90%).
- Anticoagulation immédiate par Héparine Non Fractionnée (HNF) en bolus IV, car réversible et adaptée si une procédure invasive ou thrombolyse est décidée.
- Support hémodynamique : Remplissage vasculaire prudent (max 500 ml, car une surcharge aggrave la dilatation du VD). Utilisation de vasopresseurs (Noradrénaline) et d’inotropes (Dobutamine) si nécessaire.
Stratégies de reperfusion :
- Thrombolyse systémique (Premier choix) : Indiquée chez les patients instables sans contre-indication majeure. L’altéplase (rtPA) est le plus utilisé (100 mg sur 2h). Elle réduit rapidement la postcharge VD mais comporte un risque hémorragique (notamment intracrânien).
- Embolectomie chirurgicale : Sous circulation extra-corporelle (CEC). Indiquée en cas de contre-indication à la thrombolyse, d’échec de celle-ci, ou présence de thrombus dans les cavités droites ou foramen ovale perméable.
- Traitements par cathéter (percutanés) : Fragmentation mécanique, aspiration du thrombus ou thrombolyse in-situ (doses réduites via cathéter). Alternative pour les patients à haut risque de saignement ou en cas d’échec de la lyse systémique.
Support circulatoire mécanique (ECMO)
L’ECMO veino-artérielle (VA-ECMO) peut être utilisée comme technique de sauvetage chez les patients en arrêt cardiaque réfractaire ou en choc cardiogénique très sévère, en attente d’une embolectomie chirurgicale ou d’une thrombolyse.
Traitement de l’embolie pulmonaire à risque faible ou intermédiaire
Pour la majorité des patients (normotendus) :
- Anticoagulation curative : Pierre angulaire du traitement.
- Les AOD (Anticoagulants Oraux Directs) sont recommandés en première intention par rapport aux AVK (warfarine), en raison d’un meilleur profil de sécurité (moins d’hémorragies intracrâniennes).
- Schémas thérapeutiques AOD :
- Rivaroxaban (Xarelto) : 15 mg x 2/j pendant 21 jours, puis 20 mg x 1/j (Monothérapie dès le diagnostic).
- Apixaban (Eliquis) : 10 mg x 2/j pendant 7 jours, puis 5 mg x 2/j (Monothérapie dès le diagnostic).
- Dabigatran / Edoxaban : Nécessitent un pré-traitement par HBPM (énoxaparine) pendant au moins 5 jours avant le relais oral.
- Héparines de bas poids moléculaire (HBPM) : Privilégiées en cas de cancer actif (bien que les AOD soient maintenant une alternative validée sauf cancers gastro-intestinaux) ou chez la femme enceinte.
Filtres veine cave inférieure
L’insertion d’un filtre cave n’est pas recommandée systématiquement. Les indications sont restreintes :
- Contre-indication absolue et permanente à l’anticoagulation chez un patient ayant fait une EP récente.
- Récidive d’EP prouvée malgré une anticoagulation bien conduite.
Les filtres doivent être temporaires et retirés dès que l’anticoagulation peut être reprise.
Contre-indications à la thrombolyse
Contre-indications absolues
- Antécédent d’AVC hémorragique ou d’AVC de cause inconnue (à tout moment).
- AVC ischémique au cours des 6 derniers mois.
- Néoplasie du système nerveux central.
- Traumatisme majeur, chirurgie ou traumatisme crânien récents (< 3 semaines).
- Hémorragie gastro-intestinale récente (< 1 mois).
- Saignement actif connu (hors règles).
Contre-indications relatives
- AIT (Accident Ischémique Transitoire) au cours des 6 derniers mois.
- Traitement anticoagulant oral (AVK ou AOD).
- Grossesse ou post-partum (1re semaine).
- Hypertension réfractaire (PAS > 180 mmHg).
- Maladie hépatique avancée.
- Endocardite infectieuse.
- Ulcère gastro-duodénal actif.
Durée du traitement et complications à long terme
La durée minimale de l’anticoagulation est de 3 mois. Au-delà, la décision de poursuivre (traitement étendu ou indéfini) dépend du risque de récidive (EP provoquée vs non provoquée) et du risque hémorragique.
Complications à long terme
- Syndrome post-embolique : Dyspnée persistante et intolérance à l’effort malgré une anticoagulation, touchant jusqu’à 30-40% des patients.
- Hypertension pulmonaire thromboembolique chronique (HTP-TEC ou CTEPH) : Complication rare (2-4%) mais grave où les thrombus s’organisent en tissu fibreux, obstruant les artères de manière permanente. Elle conduit à l’insuffisance cardiaque droite.
- Le dépistage est recommandé chez les patients conservant une dyspnée à 3-6 mois.
- L’examen de dépistage de choix est la scintigraphie pulmonaire V/Q (plus sensible que le scanner pour la CTEPH).
- Récidive thromboembolique.
Références
Di Nisio et al. Deep vein thrombosis and pulmonary embolism. Lancet 2016;388:3060-73
Raskob GE, Angchaisuksiri P, Blanco AN, et al. Thrombosis :
a major contributor to global disease burden. Arterioscler Thromb Vasc Biol 2014 ; 34 : 2363-71
Heit JA. Epidemiology of venous thromboembolism. Nat Rev Cardiol 2015 ; 12 : 464-74.
Kearon C et al. Natural history of venous thromboembolism. Circulation 2003 ; 107 : I22-30.
Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386-89.
Konstantinides et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society. European Heart Journal (2020) 41, 543-603.
Leitman et al. Pulmonary arteries: imaging of pulmonary embolism and beyond. Cardiovasc Diagn Ther. 2019 Aug; 9(Suppl 1): S37-S58