Réanimation cardio-pulmonaire avancée (RCP) – Assistance cardio-vasculaire avancée (ACLS)
Ce chapitre traite des interventions et des évaluations réalisées au cours de la réanimation cardio-pulmonaire avancée (ACLS – Advanced Cardiovascular Life Support). Alors que la réanimation de base (BLS) peut être pratiquée par tout témoin, la réanimation cardio-pulmonaire avancée (ACLS) est l’apanage des professionnels de la santé disposant des compétences techniques, pharmacologiques et de l’équipement requis. Bien que l’ACLS soit plus complexe et plus coûteuse que les interventions du BLS, le nombre nécessaire à traiter (NNT) pour les interventions spécifiques à l’ACLS est généralement beaucoup plus élevé, ce qui signifie que l’impact individuel de ces interventions sur la survie globale est plus faible ou plus incertain que celui des gestes de base (compressions et défibrillation précoce). En effet, c’est au cours des premières minutes suivant l’effondrement que les chances de survie se jouent. Le tableau 1 présente une comparaison du nombre de patients à traiter (NNT) pour les différentes interventions de BLS et d’ACLS.
| Intervention | BLS ou ACLS | NNT pour sauver 1 personne | Référence |
|---|---|---|---|
| Détection précoce de l’arrêt cardiaque | BLS | 11 | Berdowski et al. |
| Réanimation cardio-pulmonaire par témoin | BLS | 15 | Hasselqvist et al. |
| Défibrillation précoce | BLS (si un DEA est disponible) | 5 | Kitamura et al. |
| Adrénaline (épinéphrine) | ACLS | 112 | Perkins et al. |
| Voies aériennes avancées | ACLS | Bénéfice incertain | Panchal et al. |
| Intubation trachéale vs ventilation au masque (BAVU) | ACLS | Avantages incertains | Jabre et al. |
| Compressions mécaniques | ACLS | Pas de bénéfice supérieur | Rubertsson et al. |
| Amiodarone, lidocaïne | ACLS | Bénéfice incertain sur la survie globale | Kudenchuk et al. |
| ECMO (ECPR) | ACLS | Bénéfice variable selon sélection | Suverein et al. |
| Gestion ciblée de la température | ACLS | Pas de bénéfice (vs normothermie) | Dankiewicz et al. |
| Echocardiographie | ACLS | Aucun avantage prouvé sur la survie | Panchal et al. |
Le nombre nécessaire à traiter (NNT) est le nombre de patients à traiter pour en sauver un. Si une intervention a un NNT de 10, il faut traiter 10 personnes pour en sauver 1. Les données soulignent l’importance critique des gestes de base.
DEA = défibrillateur externe automatique. ECMO = oxygénation par membrane extracorporelle. ALS = Advanced life support.
La réanimation cardio-pulmonaire avancée (ACLS) doit être mise en œuvre le plus tôt possible, en continuité directe avec le BLS. En cas d’arrêt cardiaque extrahospitalier (OHCA), l’ACLS est pratiquée par les équipes médicales (SMUR) ou paramédicales, selon l’organisation du système de secours. Les soins spécialisés de réanimation comprennent la sécurisation d’une voie aérienne avancée, la défibrillation des rythmes choquables, l’administration de pharmacothérapies (vasopresseurs, antiarythmiques), la recherche des causes réversibles (les « 4 H et 4 T »), la stimulation cardiaque externe, et l’évaluation continue du pronostic.
Les recommandations internationales insistent sur la minimisation des interruptions des compressions thoraciques. La défibrillation doit être réalisée dans les plus brefs délais pour les rythmes choquables (FV/TV sans pouls).
L’efficacité de la RCP dépend de la qualité des compressions mais aussi de l’environnement : si nécessaire, la victime doit être déplacée sur une surface ferme pour permettre une hémodynamique efficace.
Gestion des Voies aériennes
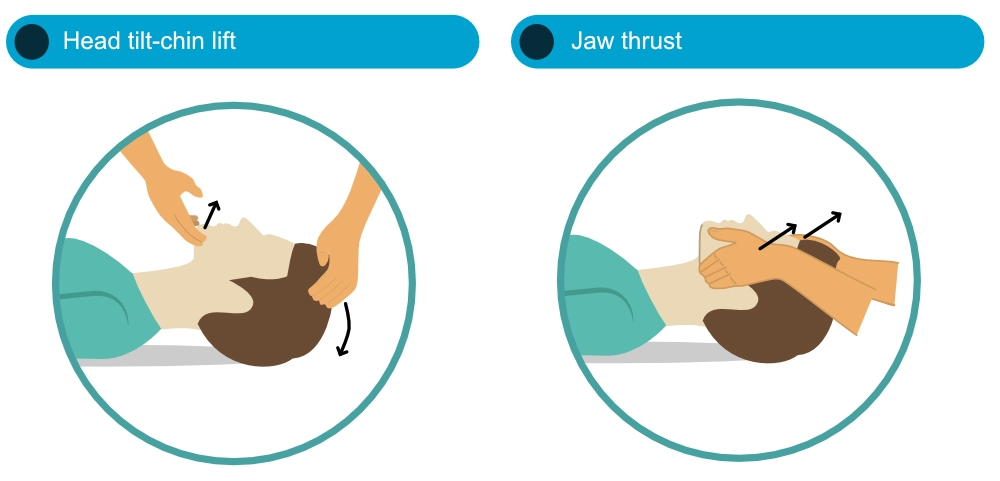
La libération des voies aériennes est une priorité initiale. La méthode de l’inclinaison de la tête et de l’élévation du menton est la manœuvre standard. Cependant, en cas de suspicion de traumatisme cervical, la subluxation de la mâchoire (jaw thrust) est préconisée pour limiter la mobilisation du rachis. Si cette dernière ne permet pas une ventilation adéquate, l’ouverture des voies aériennes prime sur la protection cervicale.
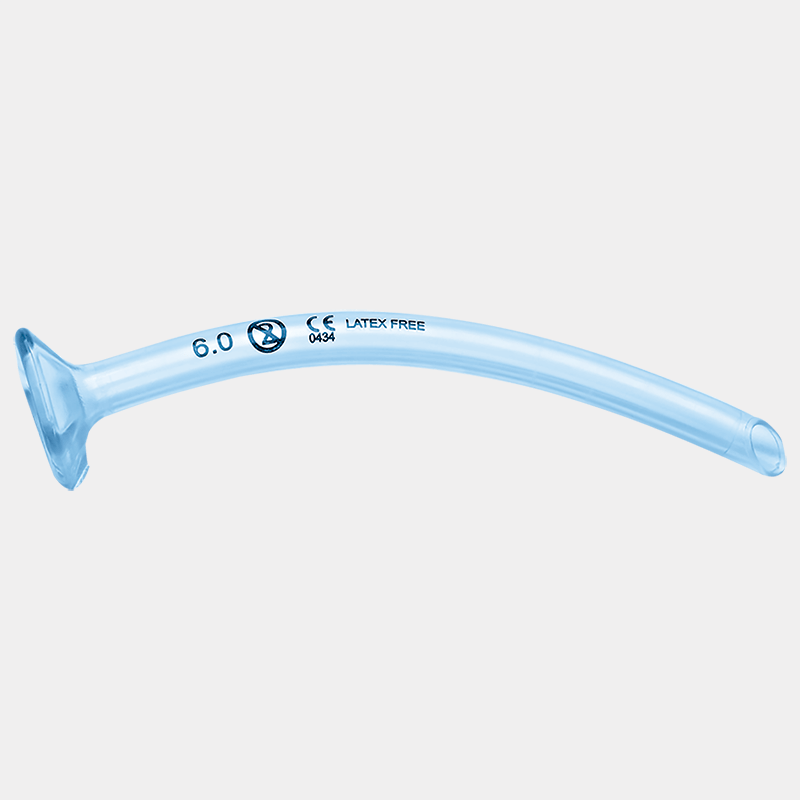
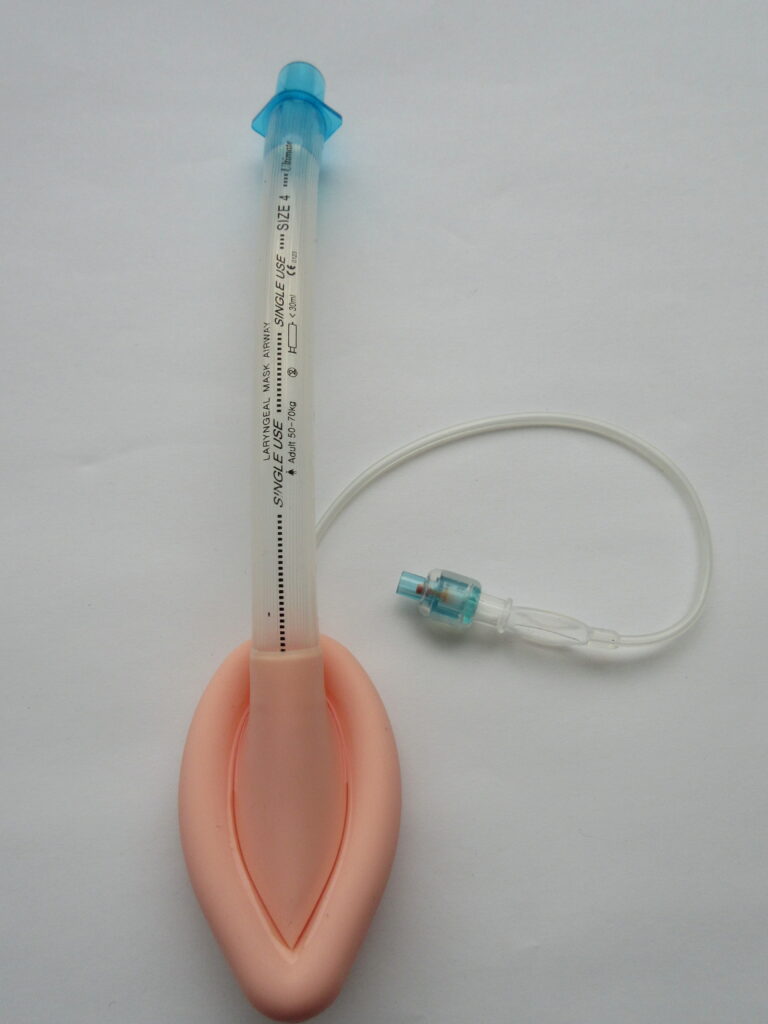
Le choix du dispositif de gestion des voies aériennes dépend de l’expertise de l’opérateur. L’intubation endotrachéale (IET) reste la référence (gold standard) car elle isole définitivement les voies aériennes et protège contre l’inhalation, à condition d’être réalisée par un opérateur expérimenté avec un minimum d’interruptions des compressions. Les dispositifs supraglottiques (masque laryngé, tube laryngé) constituent une alternative valide et souvent plus rapide pour les opérateurs moins expérimentés en intubation. Les canules oropharyngées (Guedel) facilitent la ventilation au masque en empêchant la chute de la langue en arrière.
- Une voie aérienne avancée (tube trachéal, voie supraglottique) est recommandée si la ventilation au masque est difficile ou inefficace.
- La pose du dispositif ne doit pas interrompre les compressions thoraciques pendant plus de 5 secondes. Idéalement, l’intubation est réalisée sans arrêt des compressions.
- La manœuvre de Sellick (pression cricoïdienne) n’est plus recommandée en routine car elle peut gêner l’intubation et la ventilation.
- Les canules nasopharyngées doivent être évitées en cas de traumatisme facial grave ou de suspicion de fracture de la base du crâne.
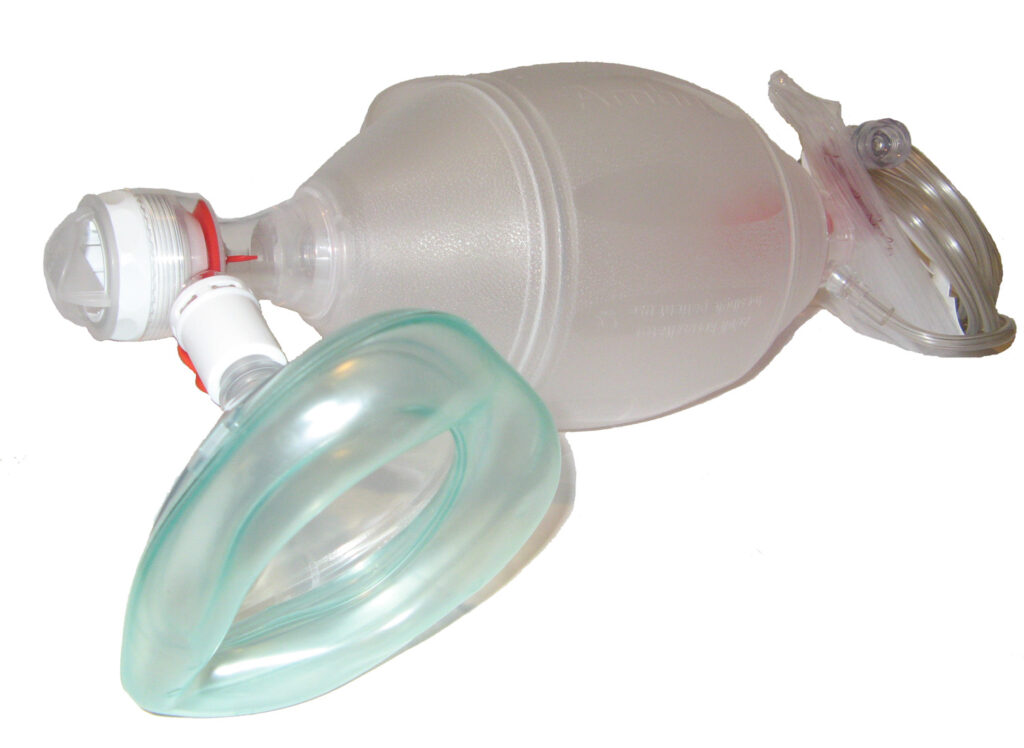


Ventilation et Oxygénation
La ventilation est assurée initialement par un ballon auto-remplisseur à valve unidirectionnelle (BAVU) raccordé à une source d’oxygène. Une technique à deux sauveteurs pour la ventilation au masque (l’un tient le masque à deux mains pour assurer l’étanchéité, l’autre comprime le ballon) est plus efficace.
Une fois qu’une voie aérienne avancée est en place, la ventilation et les compressions thoraciques sont asynchrones, c’est-à-dire que les compressions sont continues et ne sont plus interrompues pour permettre l’insufflation.
- Fréquence : 10 respirations/min (1 ventilation toutes les 6 secondes).
- FiO2 : Administrer de l’oxygène à 100 % durant la réanimation.
- Durée : Chaque insufflation doit durer environ 1 seconde.
- Volume : Viser un volume courant de 500 à 600 ml, suffisant pour obtenir un soulèvement visible du thorax sans provoquer de distension gastrique.
- Confirmation : La position correcte de la sonde d’intubation doit impérativement être confirmée par l’auscultation et, surtout, par la capnographie quantitative (etCO2), qui est la méthode de référence (voir chapitre Capnographie et arrêt cardiaque).
Attention à l’hyperventilation : Une ventilation excessive (fréquence ou volume trop élevés) est délétère. Elle augmente la pression intrathoracique, ce qui diminue le retour veineux vers le cœur et réduit par conséquent le débit cardiaque et la perfusion cérébrale.
Compressions thoraciques
Fraction de compression (Chest Compression Fraction)
La fraction de compression représente la proportion du temps total de réanimation pendant laquelle des compressions sont effectivement réalisées. L’objectif est de maintenir cette fraction au-dessus de 60 %, l’idéal étant de tendre vers 80 %. Les interruptions (pour l’analyse du rythme, les chocs, l’intubation ou les accès veineux) doivent être réduites au strict minimum. Une fraction de compression élevée est corrélée à une meilleure survie et à un meilleur pronostic neurologique (Christenson et al., Vaillancourt et al.).
Maximisez le temps de compression : la fraction de compression cible est > 60 %.
Position et Technique
Le patient doit être installé en décubitus dorsal sur un plan dur. Si le patient est sur un lit d’hôpital, l’utilisation de la fonction « CPR » du lit (durcissement du matelas) ou d’une planche dorsale est recommandée, bien que les preuves de l’impact des planches sur la survie soient limitées. L’objectif est d’éviter la dissipation de la force de compression dans un matelas mou.
Réalisation de compressions thoraciques manuelles de haute qualité
- Position des mains : Talon d’une main au centre du thorax (moitié inférieure du sternum), l’autre main au-dessus.
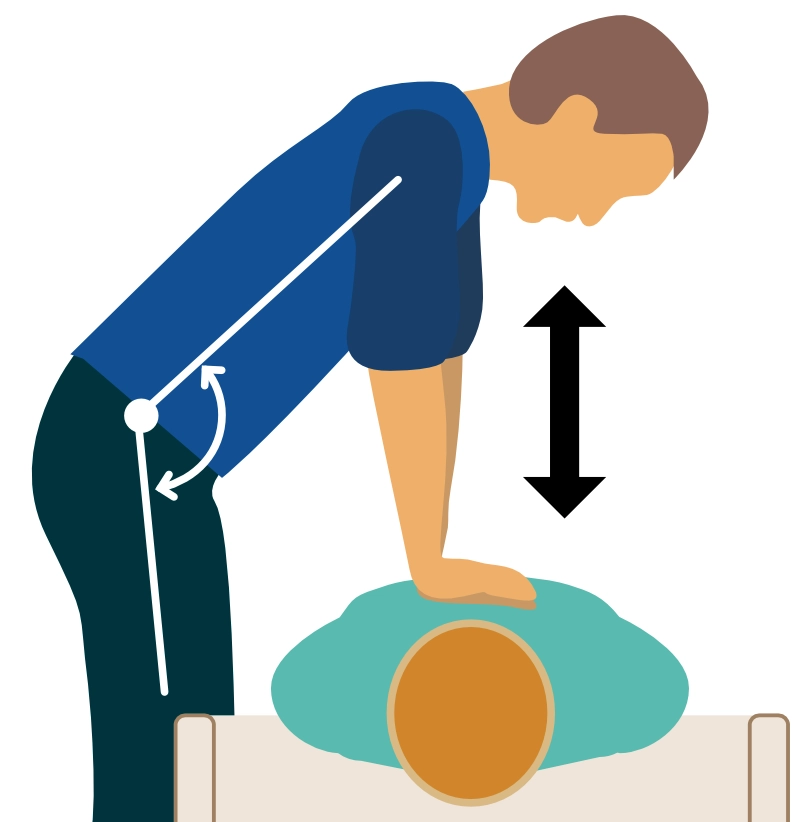
- Mécanique : Bras tendus, verrouillés aux coudes, épaules à l’aplomb du sternum. Le mouvement provient des hanches du sauveteur (Figure 3).
- Fréquence : 100 à 120 compressions par minute.
- Profondeur : 5 à 6 cm chez l’adulte.
- Recul thoracique : Laisser le thorax reprendre sa forme initiale totalement entre deux compressions pour permettre le remplissage ventriculaire. Ne pas s’appuyer sur le thorax (leaning).
- Rotation : Changer de masseur toutes les 2 minutes (ou plus tôt en cas de fatigue) pour éviter la dégradation de la qualité des compressions.
Rapport compression-ventilation
Le ratio dépend de la présence ou non d’une voie aérienne sécurisée :
- Sans voie aérienne avancée (ou avec canule Guedel) : Alternance 30 compressions / 2 ventilations. Les compressions sont interrompues pour ventiler.
- Avec voie aérienne avancée (Sonde d’intubation, masque laryngé) : Compressions continues (100-120/min) sans pause, associées à 10 ventilations/min.
Minimiser les pauses péri-choc
La phase péri-choc est critique. Les interruptions avant le choc (pre-shock pause) et après le choc (post-shock pause) diminuent drastiquement les chances de succès de la défibrillation.
- Poursuivre les compressions pendant la charge du défibrillateur.
- Ne s’écarter que le temps strictement nécessaire pour délivrer le choc.
- Reprendre immédiatement les compressions après le choc, sans vérifier le pouls ni le rythme. La vérification se fera 2 minutes plus tard.
Physiologie et Mécanismes hémodynamiques
Le chapitre Physiologie de la réanimation cardio-pulmonaire détaille les mécanismes. En bref, les compressions génèrent un flux sanguin par deux mécanismes : la pompe cardiaque (compression directe du cœur entre le sternum et la colonne) et la pompe thoracique (variations de la pression intrathoracique). La Pression de Perfusion Coronaire (PPC), qui est la différence entre la pression aortique diastolique et la pression auriculaire droite, est le déterminant majeur du ROSC (Return of Spontaneous Circulation). Une PPC > 15 mmHg est nécessaire. Chaque interruption des compressions fait chuter la PPC, qui mettra plusieurs secondes à se reconstituer lors de la reprise du massage.
Compressions mécaniques (Dispositifs automatisés)
Les dispositifs de RCP mécanique (LUCAS, AutoPulse, Corpuls CPR) permettent d’administrer des compressions standardisées. Bien que séduisants, les grands essais cliniques randomisés n’ont pas démontré de supériorité en termes de survie globale par rapport à une RCP manuelle de haute qualité.
Cependant, leur utilisation est recommandée dans des situations spécifiques où la RCP manuelle est difficile ou dangereuse pour les soignants :
- Transport prolongé ou difficile (brancardage, ambulance, hélicoptère).
- Procédure d’angiographie coronarienne (PCI) en cours.
- Préparation à une assistance circulatoire extracorporelle (ECPR/ECMO).
- Risque infectieux majeur ou intoxication.
L’installation du dispositif doit être entraînée pour limiter l’interruption du massage (objectif < 10 secondes).



Liens vers les démonstrations vidéo des fabricants :
- Corpuls 3 & Corpuls CPR
- AutoPulse
- Système de compression thoracique Physio-Control LUCAS 3
- Defibtech Lifeline ARM
Défibrillation
La défibrillation précoce est le facteur clé de survie pour les rythmes choquables : Fibrillation Ventriculaire (FV) et Tachycardie Ventriculaire (TV) sans pouls.
Positionnement des électrodes
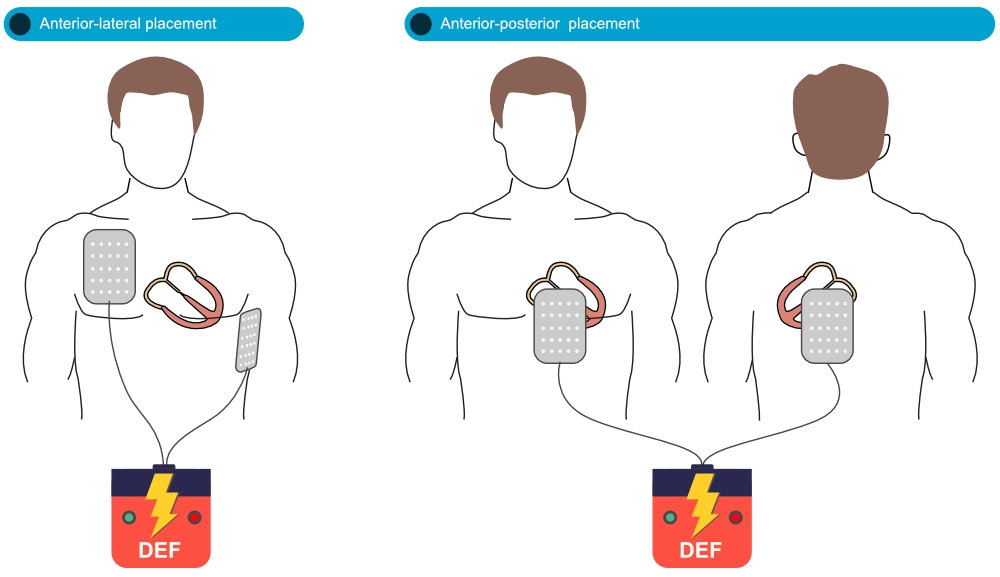
L’objectif est de faire traverser un maximum de courant à travers le myocarde ventriculaire.
- Position Antéro-Latérale (Standard) : Une électrode sous la clavicule droite (parasternale droite) et l’autre sur la ligne médio-axillaire gauche (apex du cœur, environ V6).
- Position Antéro-Postérieure : Une électrode sur le précordium (devant le cœur) et l’autre dans le dos (sous l’omoplate gauche). Cette position peut être utilisée si la position standard est impossible ou en cas d’échec de défibrillation répétée.
Énergie et Type de Choc
Les défibrillateurs actuels utilisent des ondes biphasiques, plus efficaces et moins délétères pour le myocarde que les anciennes ondes monophasiques.
- Énergie initiale : Suivre les recommandations du fabricant (souvent 120-200 Joules). À défaut, utiliser l’énergie maximale disponible.
- Escalade : En cas d’échec du premier choc, les chocs suivants doivent être délivrés à une énergie supérieure ou maximale (souvent 360 Joules sur certains appareils ou maintien de l’énergie max sur d’autres).


Fibrillation ventriculaire réfractaire
Une FV est dite réfractaire lorsqu’elle persiste après 3 chocs consécutifs. Dans ce cas, il faut :
- Vérifier la qualité des compressions.
- S’assurer de l’administration correcte des antiarythmiques (Amiodarone/Lidocaïne).
- Envisager de modifier le vecteur de défibrillation (passer les électrodes en position antéro-postérieure).
- Envisager la Défibrillation Externe Double Séquentielle (DSED) : utilisation de deux défibrillateurs pour délivrer deux chocs quasi-simultanés. Cette technique a montré des résultats prometteurs dans l’étude DOSE VF (Cheskes et al.), améliorant la survie à la sortie de l’hôpital.
Patients porteurs d’un défibrillateur implantable (DAI/ICD)
Chez les patients porteurs d’un DAI, le sauveteur peut parfois voir les muscles du patient se contracter si le DAI délivre un choc interne. Ce courant est interne et ne présente pas de danger significatif pour le sauveteur effectuant les compressions. Lors de la défibrillation externe, les électrodes ne doivent pas être placées directement sur le boîtier du DAI (généralement sous la clavicule gauche) pour éviter d’endommager l’appareil ou de réduire l’efficacité du choc (effet d’écran). Placez les électrodes à distance du boîtier (ex: position antéro-postérieure ou décalée).
Cardioversion synchronisée vs Défibrillation
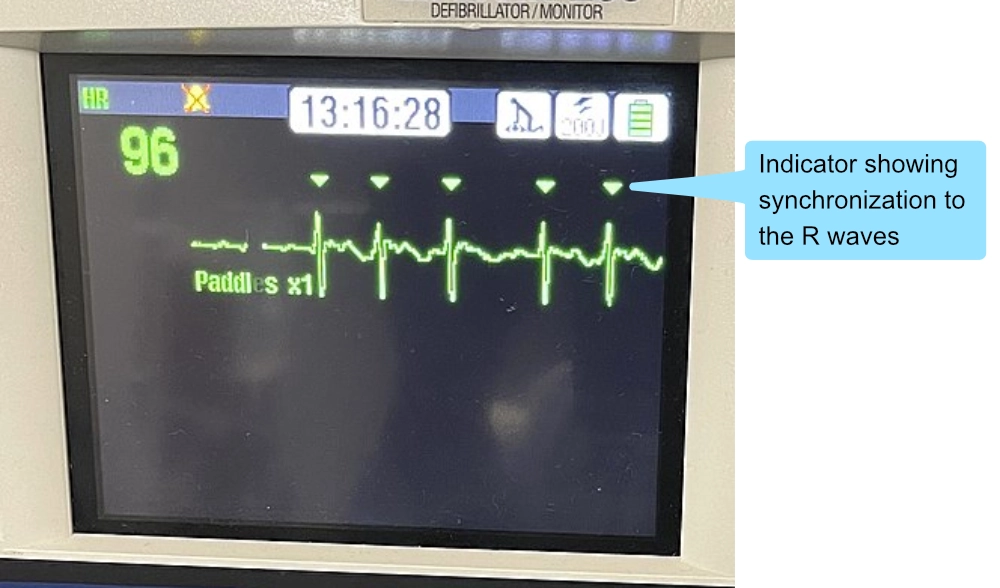
La défibrillation est un choc asynchrone utilisé pour l’arrêt cardiaque (FV/TV sans pouls). La cardioversion est un choc synchronisé sur l’onde R de l’ECG, utilisé pour les tachycardies instables avec pouls (TV avec pouls, FA rapide, Flutter).
La synchronisation est cruciale pour éviter de choquer sur l’onde T (période vulnérable), ce qui pourrait induire une fibrillation ventriculaire (phénomène R-sur-T). Le bouton « SYNC » doit être activé et des marqueurs doivent apparaître au-dessus des complexes QRS à l’écran.
Causes réversibles : Les 4 H et 4 T
La recherche étiologique doit être concomitante aux manœuvres de réanimation, en particulier en cas d’Activité Électrique Sans Pouls (AESP) ou d’Asystolie. On utilise le moyen mnémotechnique des « 4 H et 4 T » (ou 5 H et 5 T selon les variantes) :
Les H
- Hypovolémie : Cause fréquente (hémorragie, déshydratation). Signes : tachycardie complexe fin, veines plates. Traitement : Remplissage vasculaire, transfusion.
- Hypoxie : Assurer une oxygénation à 100% et vérifier la position de la sonde.
- Hydrogène (ion H+ / Acidose) : Acidose métabolique sévère préexistante. Traitement : Bonne RCP, ventilation, parfois Bicarbonates.
- Hyperkaliémie / Hypokaliémie : Troubles électrolytiques. Hyperkaliémie : ondes T amples, QRS larges. Traitement : Calcium, Insuline-Glucose, Bicarbonates. Hypokaliémie : Magnésium/Potassium.
- Hypothermie : Le patient n’est pas mort tant qu’il n’est pas « chaud et mort ». Réchauffement actif nécessaire.
Les T
- Tension (Pneumothorax sous tension) : Asymétrie auscultatoire, emphysème sous-cutané, déviation trachéale. Traitement : Décompression à l’aiguille immédiate ou thoracostomie.
- Tamponnade cardiaque : Triade de Beck (rarement complète en arrêt). Contexte (cancer, péricardite, trauma). Échographie ciblée. Traitement : Péricardiocentèse.
- Toxiques : Surdosage (opioïdes, bêta-bloquants, tricycliques). Traitement : Antidotes spécifiques si disponibles, assistance circulatoire.
- Thrombose (Coronaire ou Pulmonaire) :
- Pulmonaire (Embolie) : Contexte de TVP. Traitement : Thrombolyse (Alteplase) voire thrombectomie chirurgicale/mécanique.
- Coronaire (SCA) : Cause la plus fréquente des arrêts cardiaques subits. Traitement : Angioplastie (PCI) immédiate post-ROSC ou durant l’arrêt (sous RCP mécanique/ECMO).
Stimulation cardiaque temporaire (Pacing)
La stimulation externe transcutanée (TCP) est une mesure d’urgence pour les bradycardies instables ou symptomatiques ne répondant pas aux médicaments (Atropine), ou en cas de bloc de haut degré (BAV 2 Mobitz II, BAV 3).
Procédure de stimulation transcutanée
- Positionner les électrodes (idéalement en antéro-postérieur pour réduire l’impédance et la douleur).
- Activer le mode Stimulateur (Pacer) sur le défibrillateur.
- Régler la fréquence (généralement 60-70 bpm).
- Régler l’intensité (mA) : Augmenter progressivement le courant jusqu’à obtenir une capture électrique (un pic de stimulation suivi d’un complexe QRS large à chaque coup).
- Vérifier la capture mécanique : Palper le pouls fémoral (le pouls carotidien peut être faussé par les secousses musculaires des pectoraux) pour confirmer que chaque complexe électrique génère une onde de pouls.
- Ajouter une marge de sécurité de 2 à 10 mA au-dessus du seuil de capture.
Note : La stimulation est douloureuse chez le patient conscient. Une analgésie/sédation (Morphine, Midazolam) est souvent requise.
Médicaments de l’ACLS
Voies d’administration
L’accès intraveineux (IV) périphérique (pli du coude) est la voie de choix. Si l’accès IV est impossible après deux tentatives ou 90 secondes, la voie intra-osseuse (IO) (humérale ou tibiale) doit être mise en place immédiatement. Elle est aussi efficace que la voie centrale pour l’administration des drogues de l’ACLS.
Adrénaline (Épinéphrine)
Vasopresseur principal de l’arrêt cardiaque. Son effet alpha-adrénergique provoque une vasoconstriction périphérique, augmentant la pression diastolique aortique et donc la perfusion coronaire et cérébrale.
- Dose : 1 mg IV/IO.
- Fréquence : Toutes les 3 à 5 minutes (soit tous les 2 cycles de RCP).
- Timing :
- Rythme non choquable (Asystolie/AESP) : Administrer dès que possible.
- Rythme choquable (FV/TV) : Administrer après le 2ème échec de défibrillation.
L’étude PARAMEDIC-2 a montré que l’adrénaline augmente le taux de ROSC et la survie à 30 jours, bien qu’elle n’améliore pas significativement le pronostic neurologique favorable.
Amiodarone et Lidocaïne
Indiqués dans les FV/TV réfractaires aux chocs.
- Amiodarone : Antiarythmique de classe III.
- 1ère dose : 300 mg IV/IO en bolus (après le 3ème choc).
- 2ème dose : 150 mg IV/IO (si persistance après le 5ème choc).
- Lidocaïne : Alternative si l’amiodarone n’est pas disponible ou contre-indiquée.
- 1ère dose : 1 – 1.5 mg/kg.
- 2ème dose : 0.5 – 0.75 mg/kg.
Autres médicaments
- Sulfate de Magnésium : Indiqué uniquement pour les Torsades de Pointes (TV polymorphe associée à un QT long). Dose : 2 g IV.
- Gluconate de Calcium / Chlorure de Calcium : Indiqué en cas d’hyperkaliémie sévère, d’hypocalcémie, ou de surdosage en inhibiteurs calciques. Non recommandé en routine.
- Bicarbonate de Sodium : Indiqué pour l’hyperkaliémie sévère, l’acidose métabolique préexistante, et le surdosage en antidépresseurs tricycliques.
- Thrombolyse (rtPA/Tenecteplase) : À considérer si une embolie pulmonaire massive est suspectée comme cause de l’arrêt. Dans ce cas, la durée de la RCP doit être prolongée (60-90 min) pour laisser le temps au produit d’agir.
Signes de ROSC (Return of Spontaneous Circulation)
Le retour d’une circulation spontanée se manifeste par :
- Apparition d’un pouls palpable et d’une pression artérielle mesurable.
- Augmentation brutale et soutenue de l’ETCO2 (souvent > 40 mmHg) visible sur la capnographie.
- Apparition d’ondes de pouls artériel sur le monitorage (si cathéter artériel en place).
- Mouvements spontanés, toux ou réveil du patient.
Dès l’obtention d’un ROSC, la prise en charge bascule vers les soins post-réanimation : optimiser l’oxygénation (SpO2 92-98%), éviter l’hypocapnie/hypercapnie, traiter l’hypotension (PAS > 90 mmHg), réaliser un ECG 12 dérivations (recherche STEMI) et discuter le contrôle ciblé de la température.
Références
Tung L, Sliz N, Mulligan MR. Influence of electrical axis of stimulation on excitation of cardiac muscle cells. Circ Res. 1991 ; 69:722-730.
Steen S, Liao Q, et al. The critical importance of minimal delay between chest compressions and subsequent defibrillation. Resuscitation. 2003 ; 58 : 249-258.
Christenson J, et al. Chest compression fraction determines survival in patients with out-of-hospital ventricular fibrillation. Circulation. 2009;120:1241-1247.
Rubertsson S, et al. Mechanical Chest Compressions and Simultaneous Defibrillation vs Conventional Cardiopulmonary Resuscitation in Out-of-Hospital Cardiac Arrest: The LINC Randomized Trial. JAMA. 2014;311(1):53-61.
Perkins GD, et al. Adrenaline and Amiodarone in Out-of-Hospital Cardiac Arrest (PARAMEDIC-2). N Engl J Med 2018.
Dankiewicz J, et al. Hypothermia versus Normothermia after Out-of-Hospital Cardiac Arrest (TTM2). N Engl J Med 2021.
Cheskes S, et al. Defibrillation Strategies for Refractory Ventricular Fibrillation (DOSE VF). N Engl J Med 2022.
Soar J, et al. European Resuscitation Council Guidelines 2021: Adult advanced life support. Resuscitation. 2021.
Panchal AR, et al. 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2020.